2023年前三季度获批1类新药(除疫苗外)已达28款。其中,26款为国产创新药,两款进口上市品种。包括14款小分子创新药,9款生物药,2款多肽类化药及1款中药创新药。
据统计,2019年国家药品监督管理总局共批准了12款新药,2020年共批准了16款新药,2021年批准了39款新药,2022年批准了19款新药。相较之下,2023年前三季度上市的1类新药数量已经超过了2022年全年获批上市的1类新药。
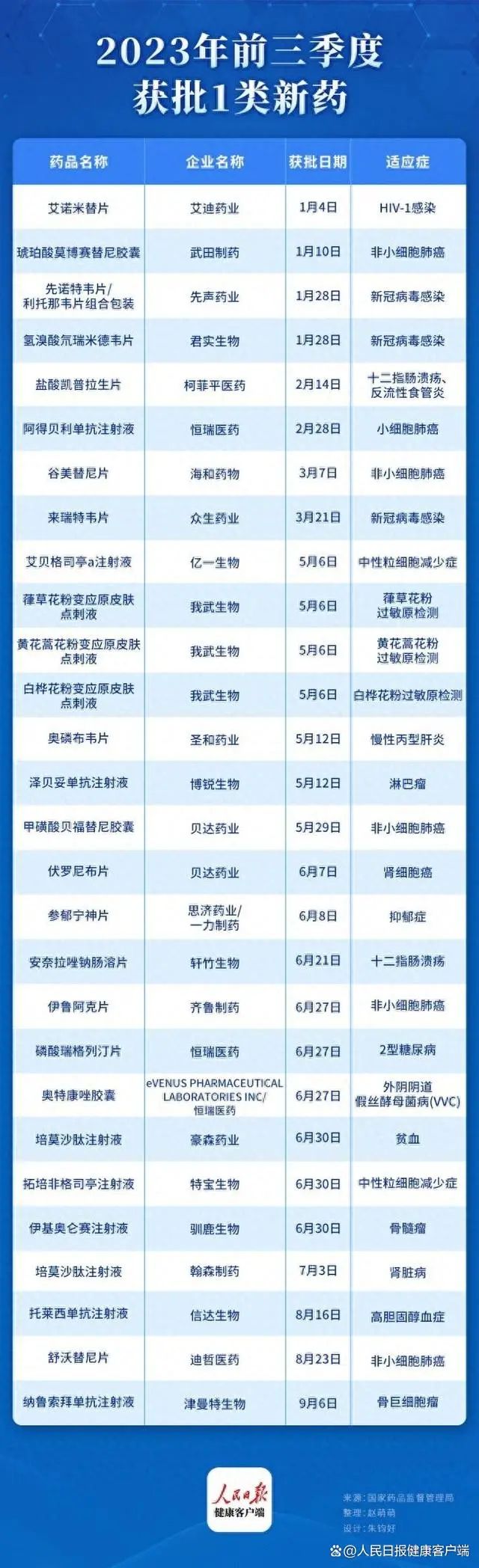
从治疗领域来看,2023年前三季度获批的1类新药中,抗肿瘤药获批数量最多,其次是抗感染药,第三为抗变态反应药物。从审评角度看,通过优先审评审批/应急审评审批方式获批上市的1类新药有5款,涉及4款化学药品和1款生物制品。
“多年前,一种创新药从审评到最终患者用上药,平均周期大概5年,纳入医保需要5~8年的时间,加快审评审批速度后,一些创新药物能够更快进入临床使用。”药盾公益基金理事解奕炯指出。
我国一直在鼓励医药创新,以满足不断增长的临床需求。根据中商产业研究院预测,2021~2025年,中国创新药市场规模将由10488亿元增至15009亿元。
2015年,药品注册管理办法(修改草案)提出,鼓励研究创制新药,对创制的新药、治疗疑难危重疾病的新药实行特殊审批。改革的启动,让创新药产业的崛起迎来了契机。
2023年4月,国家药监局药审中心针对创新药物发布《药审中心加快创新药上市许可申请审评工作规范(试行)》的通知,针对纳入突破性治疗药物程序的创新药、儿童创新药和罕见病创新药三类创新药品,明确审评审批提速。
“我国本土创新已经走过了初期‘野蛮生长’的阶段,正在迎来“大浪淘沙”的发展阶段,值得期待的是,真正具有临床价值的创新药一定会被留下。” 国家发改委宏观经济研究院生物产业发展战略专家韩祺此前接受采访时告诉记者。
内容来源:人民日报健康客户端、药招会


