作者:张珏
信销网经授权发布
CNS领域今年进展颇多。一款名为Fasedienol(PH94B)的社恐药近日引发极大关注,Fasedienol在治疗社交恐惧症(SAD)成人患者的临床III期PALISADE-2试验中达到主要终点,研发这款产品的公司VistaGen股价更是连日暴涨。
Vistagen宣称,此次公布的数据是15年来美国SAD研究疗法的“首个积极的III期研究”,更吸引人的是,它的给药方式是“微克剂量鼻内给药”,也就是鼻吸一下,15分钟内快速见效。对于依从性不高的SAD患者,可以说是再方便不过了。
“很多人平时说的‘社恐’,其实是社交焦虑。而SAD是一种真正的疾病,需要做量表进行诊断,还会有病理性的反应。社恐药是一种非常严肃的医疗产品。”蓝驰创投投资副总裁别西博士告诉动脉新医药。
对SAD有明确的疗效、临床常用的药物包括SSRIs类抗抑郁剂、苯二氮卓类,而且,抗抑郁药和标签外使用的苯二氮卓类药物都有已知的副作用和安全性问题,目前尚无FDA批准的、速效、按需治疗SAD的疗法。事实上,SAD和抑郁症等其他CNS疾病一样,都是很难攻克的疾病领域,包括Vistagen在内的多家Biotech都在这一领域也有临床试验的失败遭遇。
全球约有5%-10%的人群患有SAD,大部分人没有进行有效的治疗。社恐药结果一出股价飙升,资本市场的追捧反映了人们的真实需求。
Fasedienol的机理的确富有创新性,但PALISADE-2试验的主要和次要终点都没有包含生物标志物,数据由患者的自测量表体现。
而今年CNS领域中,ALS新药Qalsody,以及AD新药Donanemab,其突破性进展均在以生物标志物为疾病诊断或药物疗效预测的基础上实现。
没有生物标志物的“社恐药”,能带动相关市场的爆发吗?
社恐药Fasedienol的临床试验靠谱吗?
Fasedienol(PH94B)是一家老牌Biotech公司VistaGen的核心产品。VistaGen成立于1998年,但业绩始终平平,去年总营收仅有22.73万美元,还曾连续超过两个月股价低于1美元,一度面临退市危机。今年公司多个管线的好消息,为公司成功“续命”,此次Fasedienol治疗社交恐惧症(SAD)的III期临床PALISADE-2取得积极数据,更是让VistaGen体验了一把什么是“冲上云霄”。
VistaGen公司称其旨在改变焦虑、抑郁和其它CNS疾病患者的管线产品,与目前的治疗方法相比可能起效更快,副作用和安全问题更少。Fasedienol于2018年由Vistagen从Pherin Pharmaceuticals收购而来,也是其临床进展最快的一款产品。
Fasedienol是一款γ-氨基丁酸A型(GABA-A)受体调节剂,与当前所有的抗焦虑药物不同,Fasedienol通过激活外周鼻化学感应神经元,能在10-15分钟快速起效,触发大脑中抑制恐惧和焦虑的神经回路,而不是与CNS中的神经元受体结合,从而限制分子向循环系统的转运并最大限度地减少潜在的全身暴露,不需要全身摄取或引起苯二氮卓类的副作用和安全性问题。
去年7月,Fasedienol的III期PALISADE-1试验结果显示其未达到主要终点,主观焦虑评分(Subjective units of distress,SUDS)较基线的变化相比于安慰剂无显著性差异,这也是其股价遭遇严重挫折的原因。PALISADE-2试验今年3月重新开始招募,在5个月后取得了阶段性的成果。
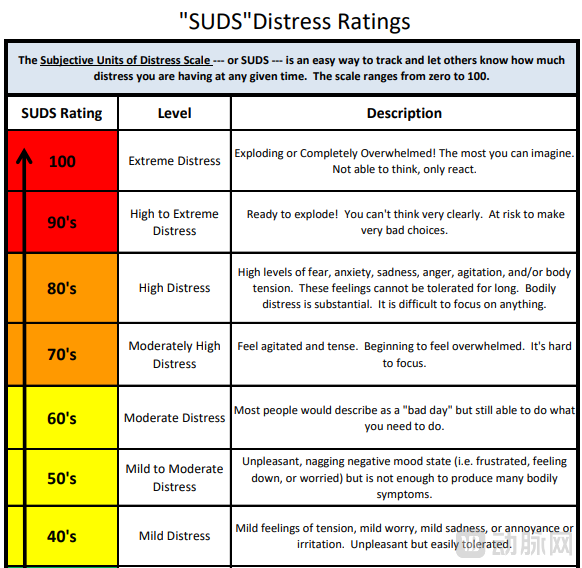
主观焦虑评分(SUDS)量表
不过,获得成功的PALISADE-2试验最终招募人数为141人,远少于设计的324人,甚至少于PALISADE-1中的209人。另外,从试验结果来看,PALISADE-2与PALISADE-1所设置的主要终点、次要终点并没有改动,但PALISADE-2主要终点(平均SUDS评分变化)显示出了针对安慰剂组的改善(-13.8分 vs. -8.0分;P=0.015),次要终点应答率(通过CGI-I量表评估)高于安慰剂组(40.6% vs. 18.6%;P=0.003),定义为焦虑程度极大降低或焦虑程度大大降低的患者比例。
有观点指出,SUDS量表和CGI-I量表侧重患者当下的主观感受,焦虑的痛苦程度几乎完全由患者自评,此类心理药物在试验中要面临更大的安慰剂效应挑战。
还需要注意的是,PALISADE-2试验是单次给药,VistaGen还将进行另外一项多次用药的III期试验,公司称向FDA递交新药申请的时间预计为2025年。
SAD的市场究竟有多大?
社恐药Fasedienol的未来走向还未可知,但可以确认的是,社恐——社交焦虑障碍(SAD)是一种严重的焦虑症,其特征是对社交或与表现相关的情况持续、强烈的恐惧。在中国的精神障碍诊断分类体系中,SAD属于神经症类。在美国DSM-IV诊断分类系统中,SAD则被归在焦虑障碍类。
SAD通常起病于17-30岁,主要是青少年期和成人早期,约80%的人从未接受治疗。SAD多呈慢性,且病程越长预后越差。据美国、加拿大、德国的流调数据显示,SAD终生患病率10%-13%。据统计,美国受SAD影响的人达2370万,而中国至少为1130万。
目前,对于社交恐惧症的治疗,主要以心理治疗和药物治疗为主。治疗药物有三类,分别是抗焦虑药物、抗抑郁药物和β受体阻滞剂。
抗抑郁药物,也就是选择性血清素再摄取抑制剂(SSRI)通常是首选药物。这类药物主要是通过抑制突触前5-HT能神经末梢对5-HT的再摄取,使突触间隙5-HT含量升高,从而提高单胺递质的神经传递而发挥抗抑郁疗效。目前主要药物为帕罗西汀(Paxil)或舍曲林(Zoloft)。
除SSRI外,血清素和去甲肾上腺素再摄取抑制剂(SNRI)也可选用来治疗社交焦虑障碍,代表药物为文拉法辛(Effexor XR)。
不过,不论是SSRI还是SNRI,这类药物的缺点在于,它们可能需要几周或几个月才能起效。对于患有SAD的患者来说,这类药物并不能立马起效来抑制急性症状的出现。
抗焦虑药物是医生治疗SAD的另一种选择。这类药物可以迅速减轻焦虑症状,但通常会被推荐作为短期解决方案。苯二氮卓类药物是一类常见的抗焦虑药物,包括阿普唑仑(Xanax)和氯硝西泮(Klonopin)。不过,2020年,美国FDA加强了对苯二氮卓类药物的监管。原因在于使用这些药物可能会导致身体依赖性,戒断可能会危及生命。将它们与酒精、阿片类药物和其他物质混合可能会导致死亡。
β受体阻滞剂也能够为SAD患者提供治疗帮助。这类药物主要针对SAD患者的生理症状,例如出汗、颤抖和心跳加快等。这类药物通过阻断肾上腺素的刺激作用来阻止焦虑对身体的影响。不过,医生通常会在特定情况下开出这些药物,例如必须进行演讲等,但不会在持续治疗时推荐患者使用。
由此看来,SAD患者确实缺少对症的治疗药物。VistaGen的CEO Shawn Singh预估,Fasedienol若获批上市,将惠及超过2500万美国患者。
不过,社恐药仍然属于小众的新药开发领域,在国内还是一片空白。目前,焦虑症在国内的患病率已高达4.98%,约有8000万患者。但一位关注CNS赛道的国内投资人表示,SAD作为焦虑症中的一个类别,在国内的市场现在很难预估,原因在于,疾病识别率低、治疗率低。根据研究显示,普通人的焦虑抑郁症的识别率大概只占到20%,一般医院的心理综合科医生识别率只能达到40%-50%,而专业的精神科或心理科医生的识别率可能也只有70%-80%。SAD未满足的临床需求仍然有待确认。
SAD折射CNS药物开发挑战,生物标志物研究或带来新的市场机会
除VistaGen外,也有其他Biotech公司在进行SAD的药物研发,这些公司在药物机制上与VistaGen不同,都进行了创新。
Ananda Scientific是一家专注于CBD(大麻二酚)药物研发的生物制药公司。不少研究显示,CBD药物对于缓解焦虑具有显著疗效。Ananda便从CBD药物入手开发了SAD新药Nantheia™ A1002N5S,并在制剂层面进行创新,使用Liquid Structure™专利投药技术,增强了药物的疗效和稳定性。2023年3月,Ananda宣布该药的临床试验已纳入首位患者。
SAD与其他CNS疾病一样,临床失败已经是一种常态。在VistaGen宣布Fasedienol的临床试验成功前,Vanda Pharmaceuticals和Bionomics在SAD临床试验中遭遇了不顺,两家公司甚至影响了VistaGen临床试验PALISADE-2的进行。
Vanda Pharmaceuticals的产品VQW-765是一款α7烟碱乙酰胆碱受体(α7-nAChR)部分激动剂。2022年12月,Vanda公布了VQW-765的临床II期数据,在业内人士来看,Vanda有闪烁其词的成分,报告显示,当接受标准化特里尔社会压力测试 (TSST) 的挑战时,与接受安慰剂的参与者相比,接受 VQW-765 的参与者的“压力水平在数字结果上较低(numerically lower stress levels)”。这一模糊说法遭到了业内质疑,也被部分人定性为临床试验的失利。相关后续临床试验还在进行中。
Bionomics则在2022年12月更加直白地表示,其候选药物 BNC210未能在治疗急性SAD的临床II期试验中达到主要终点。BNC210是α7烟碱乙酰胆碱受体的负变构调节剂,虽然临床结果并不乐观,但Bionomics 执行主席 Errol De Souza 表示,BNC210的作用机制仍然有希望,他们将评估该药治疗SAD的后续开发步骤。
SAD临床的失败,折射了整个CNS领域需要面对的问题与挑战。别西博士提到:“CNS领域大量疾病成因未明,往往涉及多个靶点和复杂机制。即使明确靶点,但是药物递送想要突破血脑屏障也很难,不像肿瘤靶向药那样明确。”此外,临床前研究使用不可靠的药效评估动物模型,患者的异质性,都会导致临床后期药效上的失败。
更加值得关注的,是CNS疾病的诊断问题。CNS疾病使用量表作为诊断标准,其主观性将影响临床试验结果。同时,安慰剂效应作为CNS药物开发的一大特点,会加大其药物开发难度,导致评价疗效结果时出现较大的偏差和不确定性。据不完全统计,在抗精神疾病药物的临床试验中,安慰剂效应可高达70%,若使用量表作为诊断标准,将为CNS药物的研发带来更大不确定性,对其他标准尤其是对生物标志物的研究显得尤为重要。
目前,基于生物标志物的疾病诊断或药物疗效预测,确实为CNS新药研发扫清了部分障碍。阿尔茨海默病的临床试验使用了生物标志物Aβ淀粉样蛋白和量表作为双重标准,推动了礼来AD新药Donanemab的积极临床结果的出炉。今年获批的ALS新药Qalsody,让产业界首次达成共识,认为神经丝轻链蛋白可以作为ALS临床试验的替代标志物,合理预测药物的临床疗效。
但生物标志物的研究并非易事,想要找到替代诊断标准其实很困难。“目前对于CNS疾病的评估,除了量表还没有更好的方式出现,在未来一段时间,也不太可能出现其他的替代标准,辅助标准则更有可能。”普百思生物创始人包杨欢博士告诉动脉新医药,“反映疗效的生物标志物是CNS领域的一个重要研究方向,虽然它还不能作为临床诊断的标准,但是可以在预测疗效上起到辅助作用,指导药物的开发。”据悉,普百思今年的重点任务聚焦在生物标志物发现、组学数据库构建与非人灵长类动物模型开发上。
关于CNS疾病生物标志物的研究,产业界已有进展。在国内,索元生物成功发现了治疗抑郁症在研新药DB104(Liafensine)的全新生物标志物DGM4 (Denovo Genomic Marker 4) ,为DB104下一步的关键性临床试验奠定了良好基础;在国外,ALTO Neuroscience基于人工智能发现的生物标志物,已经确定了哪些抑郁症或PTSD患者对当前的一系列治疗反应最好,并发现了仅使用传统临床工具无法明显识别的疾病亚型。
从去年到今年,CNS赛道呈现了百花齐放的状态,但基于生物标志物的CNS药物研发依然任重道远。


