作者:王瑾瑶
信销网经授权发布
2023年1月,已经有四款新药获得了FDA的上市批准。
1月7日,由卫材和渤健联合开发的治疗阿尔兹海默病(AD)的新药Leqembi(lecanemab)获FDA批准上市,成为了近20年来第二款获批的AD新药;1月24日,FDA批准了口服SGLT2抑制剂Brenzavvy,用于治疗2型糖尿病;1月27日,有两款新药上市,非共价BTK抑制剂Jaypirca获FDA加速批准,用以治疗复发/难治性套细胞淋巴瘤(MCL);新药Orserdu获批上市,用于治疗HER2-/ESR突变阳性的晚期转移性乳腺癌,成为FDA批准的首款口服SERD药物。
同时,1月19日,奥贝胆酸治疗非酒精性脂肪性肝炎(NASH)的新药申请已经获得FDA受理,在NASH这个数十年无药可医的疾病领域,奥贝胆酸有望在今年获批成为首款治疗药物。
这些在年初释放的新消息,一定程度上正代表了FDA在新药审批上越来越明确的方向:越来越多的治疗一种疾病的第一种、第二种药物获批;不仅严重危及生命或严重影响生活质量的疾病在被关注,不会对生命产生威胁的老年疾病、慢性病、神经系统疾病等,也成为了FDA新药审批的重点领域。
本文系统梳理并回顾了近两年FDA审批的新药。
近两年,FDA批准了9个首款药物,数量呈倍数增长
回顾近两年获批的新药,针对新适应症或者创新疗法而获批的首款药物越来越多,而且很多药物的获批具有标志性意义。
2022年6月,礼来和Incyte公司联合开发的口服JAK抑制剂巴瑞替尼获批,用于治疗严重斑秃成人患者,这是FDA批准用于治疗斑秃的首款系统性疗法;9月,勃林格殷格翰治疗罕见银屑病的疗法获批上市,是FDA首个获批的成人泛发性脓疱型银屑病发作的治疗方案;10月,Amylyx制药公司开发的渐冻症药物Relyvrio获批,成为首个既能显著减缓疾病进展与功能衰退,又能增加患者生存时间的疗法;11月,首个粪便微生物疗法获FDA批准。
再向前回溯,治疗偏头痛的Aimovig、治疗老花眼的Vuity、治疗痤疮的Clascoterone等药物相继获批上市,均为全球首款。
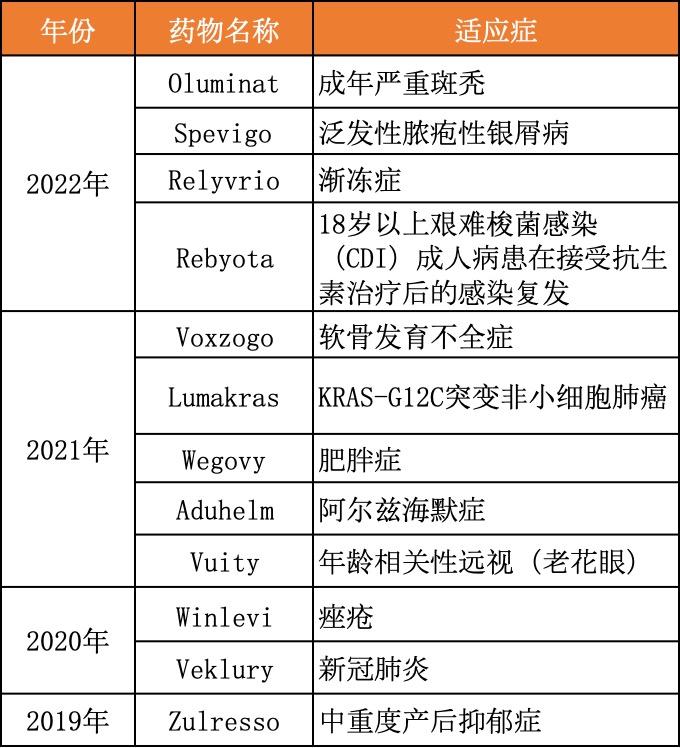
近4年FDA针对新适应症批准的首款新药及创新疗法
动脉新医药对历年针对新适应症获FDA批准的首款新药进行了统计,发现近两年FDA批准的首款新药数量,已经是2019年和2020年总和的三倍。面对一直未满足和新产生的临床需求,FDA的重视程度可见一斑,也在用行动支持药企对未满足的新临床需求加大药物研发力度。
当然,首款药物的获批,时常会伴随争议。在这些争议中,更能看出FDA明确的立场与态度。
以AD药物为例,2021年,FDA批准了Biogen研发的阿尔兹海默症新药Aduhelm上市,这是自2003年以来首个获批用于阿尔兹海默症的新疗法,也是首个针对该疾病基本病理生理学的疗法。但是,药物上市便受到业内人士的质疑,FDA甚至成为人们口中缺乏公信力的监管机构,也让这类药物研发所基于的主流理论“β淀粉样蛋白沉积(Aβ)”蒙上了阴影。
然而,审批AD药物的脚步并未停止,2023年开年,首款获批的便是AD新药。第一款和第二款新药获批的背后,是全球数千万阿尔兹海默症患者将近20年无药可医的困境,以及多家药企在这一领域的折戟。面对这种巨大的未满足的临床需求,FDA必须要通过行动鼓励药企对这类药物进行研发。
这一原则在拥有百亿美元市场空间的NASH领域中也有着明显体现。目前,FDA还没有批准过任何一款NASH药品,此前,奥贝胆酸因为安全性存疑,被FDA认定需要在说明书中加上黑框警告。最近,这一领域的好消息不少,其中最引人关注的,便是奥贝胆酸治疗NASH的NDA获得FDA受理。
非致命性适应症是审批新焦点
2022年,FDA在慢性病、皮肤病以及神经系统疾病等领域,均批准了新药上市,聚焦糖尿病、特应性皮炎、失眠等并不会危及生命的疾病上。
动脉新医药统计了2022年和2021年FDA批准的非致命性疾病治疗药物,2022年,这一方向上获批的药物达到12款,占比32%,而2021年为9款,占比18%。
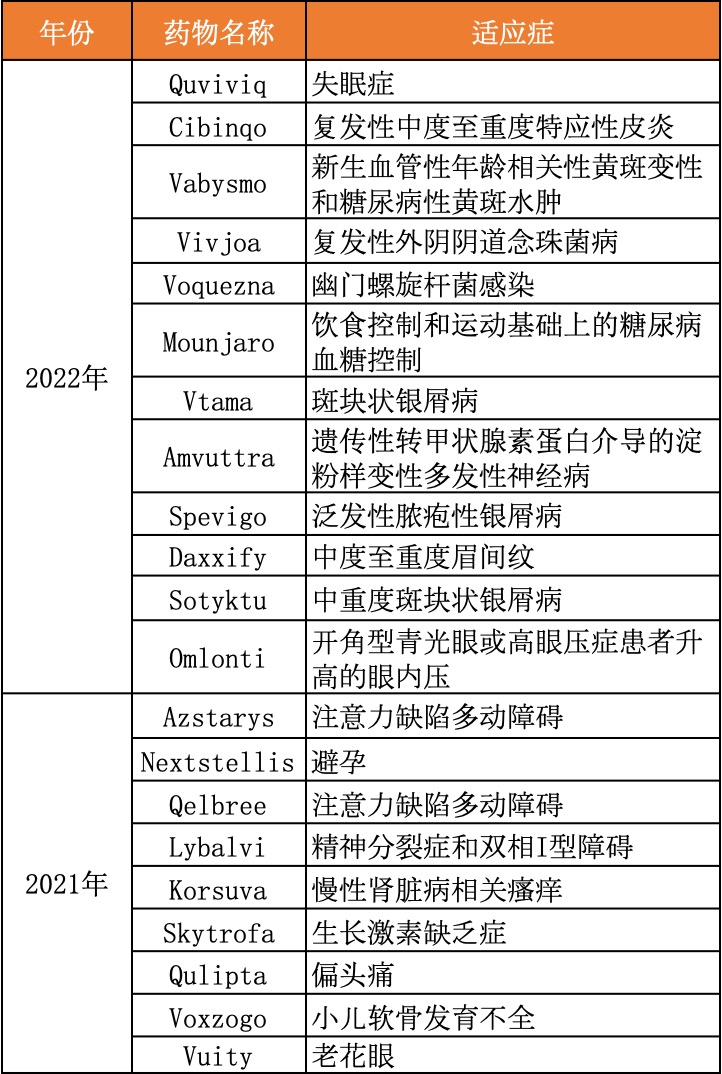
2022年和2021年FDA批准的非致命性疾病治疗药物
从2021年末获批的老花眼新药,到2022年获批的斑秃等新药,它们都表明,随着人们年龄的增长、老龄化社会的到来、生活方式的改变、现代科学认知的不断加深,过去认为一些不需要或者不能治疗的疾病,开始渐渐有了治疗方法。新的临床需求不断涌现。
在去年FDA批准上市的37款新药中,有10款为肿瘤药物,占比达到27%,虽然仍然是新药获批占比最高的疾病领域,但相比2020年获批的18款,2021年获批的13款,数量已经有了下降趋势。
一位曾加入FDA 7年、至今仍然在深度关注其新药审批动向的前资深审评员向动脉新医药印证了这一趋势。根据他的统计,FDA肿瘤药的批准数量在过去十年中,呈现出逐年下降的趋势。原因在于,现在获批的肿瘤药越来越多,对于肿瘤药物的开发,开始变得越来越难。同时,大家对于肿瘤药物产生了新的预期,在未来10到15年中,一些肿瘤会出现慢病化的趋势,这将进一步提升肿瘤药的开发难度。在国外药企中,针对肿瘤疾病的新药项目,已经开始变少。
反观中国,肿瘤依然是药企的主要阵地,对于其他有临床需求的药物研发,似乎才露出了苗头。这位FDA前审评员也透露,国内近几年上市的药企中,肿瘤药企业数量超过半数,国内药企中美双报新药的种类,占比最高的依然是肿瘤药。
在过去一年动脉新医药对初创药企的访谈中,“未满足的临床需求”几乎成为每家企业都会强调的词,这与前些年的专注跑通“new modality”不同。但产业践行以临床需求为导向,尚有一段路要走。
作为监管机构,FDA的审批犹如业内的风向标,在不断鼓励产业追求创新的过程中,核心仍然是坚持以未满足的临床需求为导向。
一位曾在FDA工作了10年左右的前审评员对动脉新医药介绍,FDA在近几年成立了Emerging Technology Program,用于协调各个部门之间对于新技术和新治疗手段的接受度,促进这些新疗法可以快速获批,以防这些创新技术会因为过度监管,而出现不能应用到临床上的困境。
不论是实施监管新举措,还是批准创新药上市,FDA展现出的鼓励创新、开放包容的审批态度,给了创新疗法落地应用的机会,也给了企业真正发展的空间。同时,这也让国内生物医药产业看到了针对新适应症开发新疗法的更多可能性与可行性,不仅能帮助国内药企打开新药研发思路,在激发行业追求创新的热情与信心上,也至关重要。


