作者:树叶
基于医药魔方网站行业快讯板块、NextPharma数据库以及公开信息,2021年9月的《临床研究月报》共筛选出10项值得关注的未达主要终点的临床研究,供您参考。
1、Margetuximab治疗乳腺癌的头对头III期研究
9月7日,MacroGenics宣布,Margetuximab对比曲妥珠单抗联合化疗治疗HER2阳性转移性乳腺癌的头对头III期SOPHIA研究(NCT02492711)在最终OS分析中并未证明具有统计学上的显著优势。

然而,事与愿违。虽然在携带CD16A 158F等位基因的探索性亚组患者中,Margetuximab联合化疗显示了更长的OS (23.3个月 vs 20.8 个月; HR=0.86; P=0.19);不过,对于CD16A 158V等位基因纯合子的亚组患者,曲妥珠单抗联合化疗的OS更长 (22.0个月 vs 31.1个月;HR=1.77; P=0.04)。
整体数据分析显示,在ITT人群中,Margetuximab联合化疗组与曲妥珠单抗联合化疗组的中位OS分别为21.6个月和21.9个月,前者并未证明具有统计学上的显著优势(HR=0.95;P=0.62)。
2020年,基于SOPHIA研究的PFS数据(中位PFS:5.8 vs 4.9个月,HR=0.76,P=0.033),Margetuximab获美国FDA完全批准,联合化疗用于既往接受过两种或两种以上抗HER2方案的HER2阳性转移性乳腺癌成年患者,其中至少有一种治疗方案用于转移性疾病。再鼎医药拥有Margetuximab在大中华区的开发及商业化权益。
点评:对于已经发现超过30年的HER2来说,小分子药的发展却不尽如人意。曲妥珠单抗、帕妥珠单抗的上市彻底改变了乳腺癌临床治疗格局,目前仍是临床首选的一线用药。同样,也鲜有产品能够在与曲妥珠单抗对抗中胜出,反倒是罗氏自己开发的帕妥珠单抗和恩美曲妥珠单抗(Kadcyla)胜出。不过,随着DS-8201与Kadcyla在头对头3期DESTINY-Breast01研究中显示出的优势,有望成为另一个胜出者。
2、ABI-H2158治疗乙肝的II期研究
9月1日,Assembly Biosciences宣布,决定停止乙肝药物ABI-H2158的临床开发,原因是一项正在进行的II期试验中,观察到谷丙转氨酶(ALT)水平升高,这与药物诱导的肝毒性一致。这是继ABI-H0731的II期临床失败的后又一乙肝药物失利。
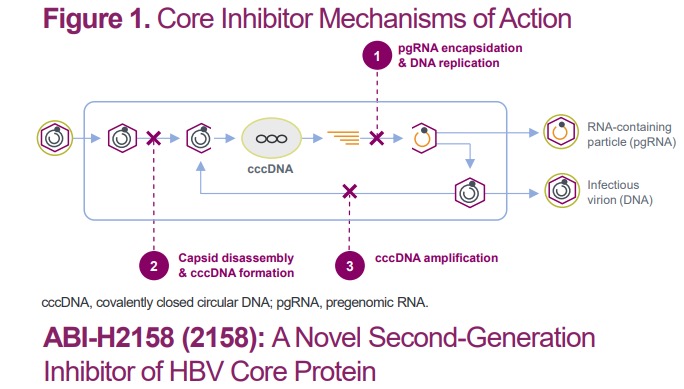
ABI-H2158通过变构结合和干扰核心蛋白二聚化来破坏HBV衣壳的形成,与第一代核心抑制剂相比,具有广泛的体外抗病毒活性;同时,抑制病毒粒子和 pgRNA 颗粒形成,抑制 cccDNA的从头形成和下游 HBeAg 和 HBsAg 的产生。
ABI-H2158的II期临床研究是一项多中心、随机、安慰剂对照试验,旨在评估ABI-H21588在HBeAg 阳性或HBeAg 阴性但无肝硬化的慢性乙型肝炎初治患者中的疗效。该试验共入组88名患者,并按3:1的比例随机接受每日一次300mgABI-H2158+恩替卡韦或安慰剂+恩替卡韦治疗,持续72周。期间,2名患者因出现4级ALT升高而停药,另有2名患者出现3级ALT升高。目前,尚未确定ALT升高的原因。基于此,Assembly Bio决定停止ABI-H215的临床开发。
2020年7月,Assembly Biosciences和百济神州就Assembly研发管线中3款用于治疗慢性乙肝的临床阶段核心抑制剂(ABI-H0731、ABI-H2158及ABI-H3733)达成合作。百济神州获得这3款乙肝药物在中国的独家开发和商业化权利,并支付给Assembly 4000万美元的首付款,以及最多5亿美元的里程碑付款。
来源:AssemblyBio官网
此前,2020年11月5日,Assembly Bio宣布,ABI-H0731的II期临床(211研究)失败。该研究未达到有意义的持续病毒学应答率(SVR),41名患者中有39名在第4-16周时复发。
3、AT132治疗X连锁肌管性肌病的I/II期研究
9月1日,安斯泰来(Astellas)宣布,已自愿暂停AT132治疗X连锁患者肌管性肌病(XLMTM)的I/II期临床研究(ASPIRO)。该决定是在以较低剂量(1.3x10e14 vg/kg)给予AT132后,数周内观察到异常肝功能(LFT)严重不良事件(SAE)后作出的,并向监管机构报告了严重不良事件(SAE)。

X连锁肌管肌病 (XLMTM)是一种由MTM1基因突变引起的罕见、危及生命的单基因神经肌肉疾病,大约每40,000-50,000 名新生男孩中就会出现1例,估计18个月内死亡率为50%,目前尚无可用的治疗方法,存在大量未满足的临床需求。AT132是安斯泰来在2019年收购Audentes Therapeutics时获得的一种基因疗法。
迄今为止,共24名受试者接受了AT132的治疗:7人接受了1.3x1014 vg/kg剂量的治疗,17人接受了3.5x1014 vg/kg剂量的治疗。2020年8月,安斯泰来宣布MTM1基因疗法AT132导致了第三名患者死亡,死亡的三位患者均接受3.5x1014 vg/kg剂量治疗,且均具有肝胆病史,先后出现进展性胆汁淤积性肝炎,并死于败血症(2例)或胃肠道出血(1例),所有这些都是肝衰竭的后果。
4、强生HIV疫苗预防HIV感染的IIb期研究
9月1日,pharmashots报道,强生将终止在撒哈拉以南非洲地区开展的IIb期 Imbokodo 临床试验 (HVTN705/HPX2008),源自强生公司的报告中指出,这种实验性人类免疫缺陷病毒 (HIV) 疫苗未能提供对该疾病的实质性保护。
IIb期概念验证Imbokodo试验在五个撒哈拉以南非洲国家(即马拉维、莫桑比克、南非、赞比亚和津巴布韦)的 23 个试验地点招募了近 2,600 名HIV感染风险较高的年轻女性。一年内对受试者进行了四次疫苗接种,并在第一剂疫苗注射后24个月进行初步分析。主要终点定义为第7个月至第24个月,疫苗接种组与安慰剂组HIV新发感染数量的差异。
试验结果显示,随访第24个月时,安慰剂组1109名受试者中有63人感染了艾滋病,而疫苗接种组1079名受试者中有51人发生感染,该疫苗的效力估计仅为25.2%,置信区间低于0%。
5、Pevonedistat治疗多项疾病的III期研究
9月1日,武田宣布,pevonedistat联合阿扎胞苷一线治疗高危骨髓增生异常综合征(MDS)、慢性骨髓单核细胞白血病(CMML)和低成粒细胞急性髓系白血病(AML)的III期PANTHER 研究(Pevonedistat-3001)未达到预先设定的无事件生存期(EFS)的主要终点。
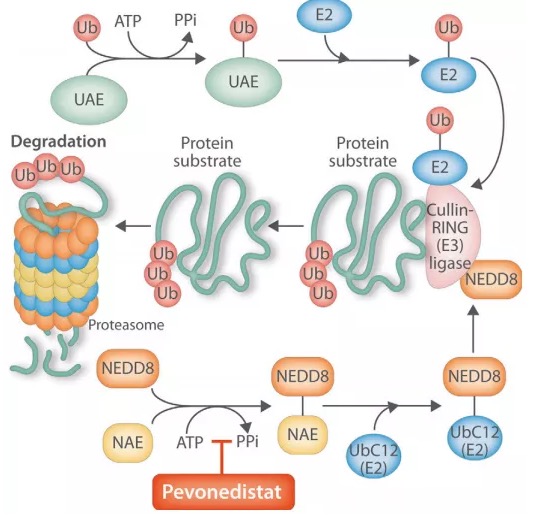
Pevonedistat作用机制
Pevonedistat是一款first-in-class 的NEDD8活化酶(NAE)小分子抑制剂,通过抑制NAE,抑制关键连接酶CRL泛素化过程中的正常激活,干扰蛋白酶体对细胞靶标的降解,从而影响细胞周期、凋亡和DNA复制,导致癌细胞死亡。
此前,Pevonedistat代号为Pevonedistat-2001的II期临床试验数据获FDA突破性疗法认定,用于治疗高风险骨髓增生异常综合征(HR-MDS)。
6、FB-401治疗特应性皮炎的II期研究
9月2日,Forte Biosciences宣布FB-401治疗特应性皮炎的Ⅱ期临床试验的顶线数据,结果表明,该研究未能达到EASI-50主要终点的统计学显著性,主要终点定义为根据湿疹面积和严重程度指数(EASI)评估,特应性皮炎疾病严重程度至少改善50%的患者比例。
9月3日(周五),受该消息影响,Forte公司的股票从周四的收盘价28.59美元跌至 5.06美元,跌幅超过82%。不过,Forte Biosciences此前报告称,截至2021年6月30日,其现金和现金等价物为5080万美元,足够为未来一年内提供资金保障。

7、Iscalimab用于肾脏移植排斥的II期研究
9月3日,诺华宣布终止一项CFZ533 (iscalimab)预防肾脏移植手术患者器官移植排斥的CIRRUS-1研究。这一决定是在该研究的中期分析以后做出的。
中期分析显示,对于接受肾脏移植手术的患者,在接受其他免疫抑制剂(诱导疗法、麦考酚酯和皮质激素)的基础上,联合使用CFZ533 预防器官移植排斥的疗效不如他克莫司。诺华目前仍在进一步评估CIRRUS-1研究的试验数据,待完成后将与科学委员会详细沟通。
CFZ533(iscalimab)是从lucatumumab改造而来,在Fc区引入N297A突变,从而丧失结合FcγR的能力,没有了Fc介导的效应。Iscalimab不会清除B细胞,但是能够抑制CD40信号通路激活。
目前,CFZ533针对肝脏移植患者以及化脓性汗腺炎、舍格伦综合征等适应症的临床试验仍在进行中。
8、Rilzabrutinib治疗天疱疮的III期研究
9月9日,赛诺菲更新了Rilzabrutinib 治疗天疱疮(一种罕见的自身免疫性皮肤病)的III期研究(PEGASUS)的最新结果,显示未达到其主要或关键次要终点。
PEGASUS是一项随机、平行、双盲、安慰剂对照的III期临床试验,同时也是首个和进展最快的BTK抑制剂治疗天疱疮的安慰剂对照试验。在全球19个国家或地区招募了131名新诊断或复发的中重度天疱疮患者。主要终点是第29周至第37周使用最小剂量(≤10毫克/天)皮质类固醇药物(CS)患者的完全缓解率。
天疱疮是一种可能危及生命的自身免疫性疾病,临床特征以影响皮肤和粘膜的水疱和溃疡为主。目前治疗天疱疮(包括寻常型和落叶型)的选择有限,全身性皮质类固醇治疗仍然是标准治疗。
BTK酶在多种免疫过程中具有重要作用,包括B细胞扩增、免疫球蛋白的产生以及先天免疫系统细胞(如肥大细胞、嗜酸性粒细胞和嗜碱性粒细胞)的激活。因此,该类药物具有潜力适用于多种自身免疫性疾病,包括类风湿性关节炎、慢性自发性荨麻疹以及多发性硬化症等。除了Rilzabrutinib,赛诺菲获得的另外一款BTK抑制剂Tolebrutinib就被开发用于多发性硬化症的治疗,并在全球首次完成概念验证临床研究。
9、Pegcetacoplan治疗地图样萎缩(GA)的III期研究
9月9日,Apellis Pharmaceuticals公布了靶向补体C3蛋白的pegcetacoplan在两项III期临床试验DERBY和OAKS的顶线结果。
两项研究共纳入1,258 名年龄相关性黄斑变性(AMD)的地图样萎缩(GA)成人患者,其中OAKS 研究达到了主要终点,pegcetacoplan 每月或隔月治疗组的GA 病变增长分别显著减少了22%(p=0.0003)和16%(p=0.0052)。然而,DERBY研究却未达到GA 病变生长的主要终点(12% vs 11%)。根据研究结果,该公司计划2022 年上半年提交新药申请 (NDA)。尽管如此,Apellis盘后股价仍然大跌31.67%。
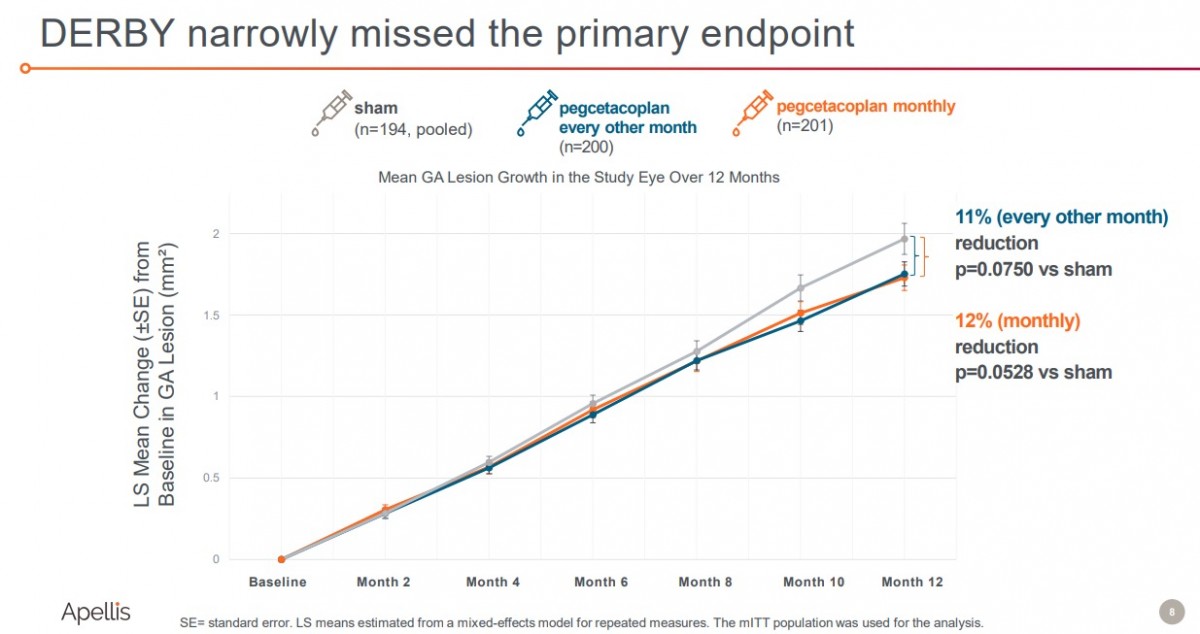
DERBY研究未达主要终点(来源:Apellis)

Pegcetacoplan药物介绍(来源:Apellis)
9月27日,Biohaven公布了一项Verdiperstat 治疗多系统萎缩症(MSA)III期研究的分析结果。无论是预先指定的主要疗效指标,亦或是关键的次要疗效指标上,Verdiperstat均未与安慰剂达到统计学显著差异。安全性数据的初步分析与此前的总体情况一致。
Verdiperstat在研适应症(来源:Biohaven)
目前,MSA没有可用的治疗方法,通常仅接受对症和姑息治疗。由于存在大量未满足的临床需求,Verdiperstat 此前已获得FDA和欧洲药品管理局的快速通道和孤儿药认定。
Verdiperstat是一种first-in-class的强效、选择性的脑渗透性和不可逆髓过氧化物酶(MPO)抑制剂,被Biohaven开发用于治疗神经退行性疾病。Verdiperstat 可能通过抑制MPO 诱导的病理性氧化应激和导致神经退行性疾病细胞损伤的炎症来帮助保护神经元。虽然,verdiperstat的作用机制被证明对MSA无效,不过,Biohaven正在与马萨诸塞州总医院的Sean M. Healey & AMGALS 中心合作开展verdiperstat 治疗肌萎缩侧索硬化症(ALS)的临床试验,预计将于2021年第四季度完成招募。
Verdiperstat最早由阿斯利康开发,已经完成了七项临床研究,包括四项针对健康受试者的I期研究、两项针对帕金森病受试者的 IIa 期研究以及一项针对MSA受试者的 IIb 期研究。Biohaven在2018年获得了该药物全球权益,支付了700多万美元的现金和股票。
除了上述10项临床失利之外,RedHill Biopharma的Opaganib治疗严重COVID-19的II/III期研究、Aerie Pharmaceuticals的AR-15512 治疗干眼病IIb期临床试验、Theravance Biopharma的Ampreloxetine治疗症状神经源性直立性低血压(nOH)的III期研究、以及施维雅和Neurochlore的布美他尼(bumetanide)治疗孤独症谱系障碍(ASD)的两项III期临床试验等,在本月公布的结果中,均未达到研究的主要终点或显示治疗功效。
参考资料:
1.http://ir.macrogenics.com/news-releases/news-release-details/macrogenics-announces-final-overall-survival-results-sophia
2.https://mp.weixin.qq.com/s/D7z3_OYTEbBAzuYkScxsQw;
https://investor.assemblybio.com/news-releases/news-release-details/assembly-bio-announces-decision-discontinue-clinical-development
3.https://www.astellas.com/en/news/17121
4.https://pharmashots.com/64015/johnson-johnson-discontinues-the-p-iib-imbokodo-trial-of-hiv-vaccine-regimen-for-hiv-infection/
https://www.iavi.org/news-resources/features/iavi-statement-on-results-from-phase-iib-imbokodo-hiv-vaccine-clinical-trial
5.https://www.takeda.com/newsroom/newsreleases/2021/takeda-provides-update-on-phase-3-panther-pevonedistat-3001-trial/
https://mp.weixin.qq.com/s/7bIhyYDmF0MEMZE4F54jOg
6.https://www.fortebiorx.com/investor-relations/news/news-details/2021/Clinical-Trial-of-FB-401-For-the-Treatment-of-Atopic-Dermatitis-Fails-to-Meet-Statistical-Significance/default.aspx
7.https://mp.weixin.qq.com/s/RXmN3cy2faF_35ym1jsC3g
8.https://www.sanofi.com/en/media-room/press-releases/2021/2021-09-09-07-00-00-2293920
9.https://investors.apellis.com/news-releases/news-release-details/apellis-announces-top-line-results-phase-3-derby-and-oaks
10.https://www.biohavenpharma.com/investors/news-events/press-releases/09-27-2021


