文章来源:医药魔方Pro
作者:黎元
mRNA技术在新冠疫情中脱颖而出,多家机构和媒体都预测今年的诺奖非mRNA技术莫属,但是在可能或应该获奖的人选上却存在一些争议。
随着诺奖公布的时间越来越近,围绕在人物上的争议也越来越多,Katalin Karikó和Drew Weissman二人开发了优秀的mRNA修饰技术,被认为是最具潜力的诺奖人选,但是mRNA疫苗的诞生和发展有着大量研究人员不断地去探索和推动,对于谁才是mRNA疫苗最关键的人物,关于技术起源与发展、围绕在mRNA本身和mRNA疫苗递送等领域有着许多纷争。
mRNA疫苗技术的起源与发展
早在1978年,科学家们尝试使用脂质体将mRNA转运到小鼠和人类细胞中诱导蛋白质的表达,他们发现经由脂质体包装的mRNA能与细胞膜融合,并将mRNA递送到细胞中。
mRNA在胞内的表达发现于1987年,当时在美国加州Salk生物研究所攻读博士的Robert Malone发现将mRNA与脂滴混合可以促使人类细胞吸收mRNA并产生mRNA编码的蛋白质。在1988年,Malone还证明了青蛙胚胎也能吸收这种方法递送的mRNA。
但是mRNA应用的最大难题就是mRNA的不稳定性,而且进入细胞的mRNA会被免疫系统识别为病毒遗传物质而清除掉,无法发挥翻译蛋白的功能。Katalin Karikó和Drew Weissman在mRNA的修饰上做出了关键一步。
Karikó在开发出稳定的mRNA之前,她的科研之旅并不顺畅,申请资金屡次被拒绝,而且多次被机构降职,她辗转多地艰难地坚持着自己在mRNA上的研究,她对Malone的方案进行了改进,想要诱导细胞产生具有治疗作用的蛋白质。虽然屡经挫折,但是最后她遇到了Weissman。
1997年,Karikó和Weissman开始研发艾滋病mRNA疫苗,二人在合作研究的过程中注意到,tRNA不会引发机体过度的免疫应答,原因在于tRNA结构中的假尿苷。于是他们试着将假尿苷添加到mRNA中,这是关键的一步,2005年,两人发表论文,这种修饰后的mRNA在进入细胞后可以像tRNA一样免于免疫系统的攻击,进而发挥自己“指令员”的作用,在细胞内翻译出特定的蛋白质。
这一突破最终被Moderna的创始人之一Derrick Rossi注意到,Rossi根据Karikó和Weissman的修饰方法获得了稳定的mRNA,另一家mRNA疫苗明星公司BioNTech也在2013年聘请了Karikó担任公司的高级副总裁。
Malone一直称自己为mRNA疫苗技术的发明人,据Malone透露,他在首次发现mRNA在医学中的应用潜力后,便把这些发现和感想记在了笔记本上,签字并注明了日期。
虽然Malone成功将mRNA递送到了人类细胞和青蛙胚胎中,但Malone最后与博士导师Inder Verma发生了一些不愉快,他离开了学校,去到了医药公司Vical进行工作。
在Vical,Malone和同事合作证明了脂质-mRNA复合物可以刺激小鼠产生蛋白质,相关论文发表在了Science。
作者:黎元
mRNA技术在新冠疫情中脱颖而出,多家机构和媒体都预测今年的诺奖非mRNA技术莫属,但是在可能或应该获奖的人选上却存在一些争议。
随着诺奖公布的时间越来越近,围绕在人物上的争议也越来越多,Katalin Karikó和Drew Weissman二人开发了优秀的mRNA修饰技术,被认为是最具潜力的诺奖人选,但是mRNA疫苗的诞生和发展有着大量研究人员不断地去探索和推动,对于谁才是mRNA疫苗最关键的人物,关于技术起源与发展、围绕在mRNA本身和mRNA疫苗递送等领域有着许多纷争。
mRNA疫苗技术的起源与发展
早在1978年,科学家们尝试使用脂质体将mRNA转运到小鼠和人类细胞中诱导蛋白质的表达,他们发现经由脂质体包装的mRNA能与细胞膜融合,并将mRNA递送到细胞中。
mRNA在胞内的表达发现于1987年,当时在美国加州Salk生物研究所攻读博士的Robert Malone发现将mRNA与脂滴混合可以促使人类细胞吸收mRNA并产生mRNA编码的蛋白质。在1988年,Malone还证明了青蛙胚胎也能吸收这种方法递送的mRNA。
但是mRNA应用的最大难题就是mRNA的不稳定性,而且进入细胞的mRNA会被免疫系统识别为病毒遗传物质而清除掉,无法发挥翻译蛋白的功能。Katalin Karikó和Drew Weissman在mRNA的修饰上做出了关键一步。
Karikó在开发出稳定的mRNA之前,她的科研之旅并不顺畅,申请资金屡次被拒绝,而且多次被机构降职,她辗转多地艰难地坚持着自己在mRNA上的研究,她对Malone的方案进行了改进,想要诱导细胞产生具有治疗作用的蛋白质。虽然屡经挫折,但是最后她遇到了Weissman。
1997年,Karikó和Weissman开始研发艾滋病mRNA疫苗,二人在合作研究的过程中注意到,tRNA不会引发机体过度的免疫应答,原因在于tRNA结构中的假尿苷。于是他们试着将假尿苷添加到mRNA中,这是关键的一步,2005年,两人发表论文,这种修饰后的mRNA在进入细胞后可以像tRNA一样免于免疫系统的攻击,进而发挥自己“指令员”的作用,在细胞内翻译出特定的蛋白质。
这一突破最终被Moderna的创始人之一Derrick Rossi注意到,Rossi根据Karikó和Weissman的修饰方法获得了稳定的mRNA,另一家mRNA疫苗明星公司BioNTech也在2013年聘请了Karikó担任公司的高级副总裁。
Malone一直称自己为mRNA疫苗技术的发明人,据Malone透露,他在首次发现mRNA在医学中的应用潜力后,便把这些发现和感想记在了笔记本上,签字并注明了日期。
虽然Malone成功将mRNA递送到了人类细胞和青蛙胚胎中,但Malone最后与博士导师Inder Verma发生了一些不愉快,他离开了学校,去到了医药公司Vical进行工作。
在Vical,Malone和同事合作证明了脂质-mRNA复合物可以刺激小鼠产生蛋白质,相关论文发表在了Science。

Robert Malone实验室笔记本的摘录,描述了1989年合成的用于注射到小鼠体内的mRNA(来源:Robert Malone)
在Malone身上还有一些戏剧性的情节,在mRNA疫苗获得了全球关注后,国外一些主流媒体对mRNA疫苗技术的报道中也并没有提到他,他开始频繁发声,称自己是mRNA疫苗的发明人,但是这项技术不够成熟,不适合推广,同时他也指控Karikó夸大自己的贡献。Malone的对外发声得到了反疫苗人群的拥护和认可,他现在已是反疫苗人群中的“mRNA疫苗发明者”……
mRNA的体外合成
在上面的介绍中我们了解到,mRNA可以被递送到细胞内并能稳定地表达蛋白质,但距离mRNA成为一种药物显然还有着很多的困难。例如,实验室所用的mRNA都来自于实验动物,mRNA要想作为一种药物,一个重要条件是可以体外合成。
1984年,亚利桑那大学的发育生物学家Paul Krieg和哈佛大学的发育生物学家Douglas Melton团队利用一种病毒来源的RNA合成酶在实验室中产生了具有生物活性的mRNA,然后Krieg将实验室制造出来的mRNA注射到青蛙卵中,证明了合成的与天然的mRNA一样有效。
Melton和Krieg都表示,他们将合成mRNA主要视为研究基因功能和活性的研究工具。1987年,Melton发现mRNA既能激活也能抑制蛋白的生产,在他的推动下,Oligogen成立了,也就是后来的吉利德。Oligogen成立的目的是为了探索利用合成RNA抑制靶蛋白表达的方法,Melton的研发团队并没有想到将合成的mRNA用作疫苗。
mRNA递送技术开发关键
mRNA疫苗的诞生除了得益于使mRNA稳定表达和体外mRNA合成的关键技术,还有一项技术至关重要:将mRNA递送到胞内。
这项技术就是脂质纳米颗粒(LNP),LNP技术来自英属哥伦比亚大学的生物化学家Pieter Cullis和他创立或领导的几家公司的实验室。从上世纪90年代后期开始,他们率先将LNP用于递送能沉默基因的核酸链。代表药物就是patisiran,2018年获FDA批准上市,用于治疗转甲状腺素蛋白家族性淀粉样多发性神经病(TTR-FAP)。
2012年,Cullis的两家公司转向探索LNP递送系统在mRNA药物中的应用机会。其中,Acuitas Therapeutics与Weissman团队和几家mRNA公司建立了合作关系,测试了不同类型的mRNA-LNP复合物,现在BioNTech和CureVac的新冠疫苗就应用了这其中的LNP类型,Moderna的LNP混合物也与此类似。
mRNA的体外合成
在上面的介绍中我们了解到,mRNA可以被递送到细胞内并能稳定地表达蛋白质,但距离mRNA成为一种药物显然还有着很多的困难。例如,实验室所用的mRNA都来自于实验动物,mRNA要想作为一种药物,一个重要条件是可以体外合成。
1984年,亚利桑那大学的发育生物学家Paul Krieg和哈佛大学的发育生物学家Douglas Melton团队利用一种病毒来源的RNA合成酶在实验室中产生了具有生物活性的mRNA,然后Krieg将实验室制造出来的mRNA注射到青蛙卵中,证明了合成的与天然的mRNA一样有效。
Melton和Krieg都表示,他们将合成mRNA主要视为研究基因功能和活性的研究工具。1987年,Melton发现mRNA既能激活也能抑制蛋白的生产,在他的推动下,Oligogen成立了,也就是后来的吉利德。Oligogen成立的目的是为了探索利用合成RNA抑制靶蛋白表达的方法,Melton的研发团队并没有想到将合成的mRNA用作疫苗。
mRNA递送技术开发关键
mRNA疫苗的诞生除了得益于使mRNA稳定表达和体外mRNA合成的关键技术,还有一项技术至关重要:将mRNA递送到胞内。
这项技术就是脂质纳米颗粒(LNP),LNP技术来自英属哥伦比亚大学的生物化学家Pieter Cullis和他创立或领导的几家公司的实验室。从上世纪90年代后期开始,他们率先将LNP用于递送能沉默基因的核酸链。代表药物就是patisiran,2018年获FDA批准上市,用于治疗转甲状腺素蛋白家族性淀粉样多发性神经病(TTR-FAP)。
2012年,Cullis的两家公司转向探索LNP递送系统在mRNA药物中的应用机会。其中,Acuitas Therapeutics与Weissman团队和几家mRNA公司建立了合作关系,测试了不同类型的mRNA-LNP复合物,现在BioNTech和CureVac的新冠疫苗就应用了这其中的LNP类型,Moderna的LNP混合物也与此类似。
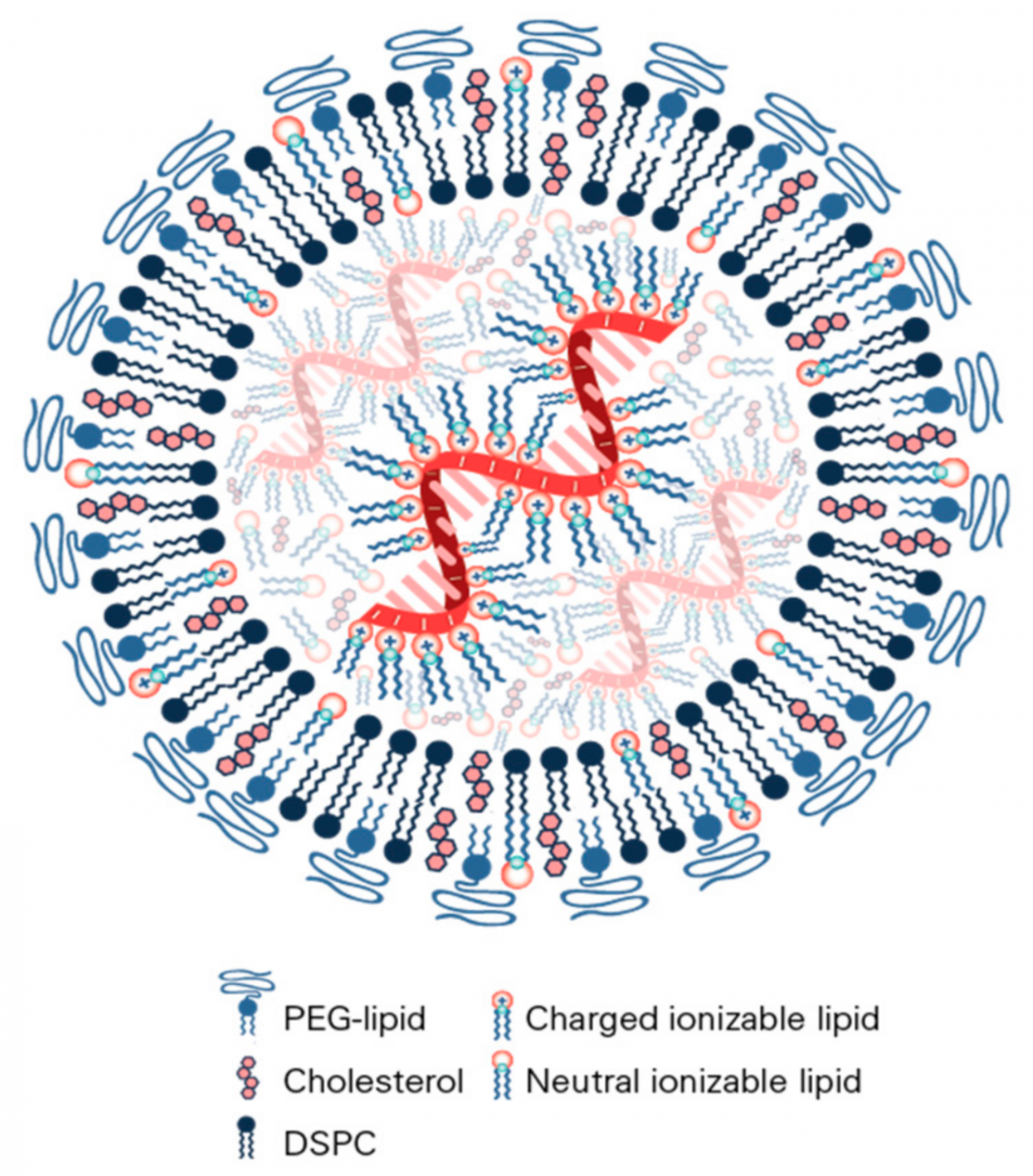
LNP的结构(来源:参考资料[4])
LNP是4种脂肪分子的混合物,其中3种有助于提高粒子的结构和稳定性,第4种是可电离脂质,也是LNP成功的关键。这种物质在实验室条件下带正电荷,与Philip Felgner开发和Malone在实验中测试的脂质体具有相似的优势(Malone使用了一种带正电荷的脂质体,能增强材料与mRNA带负电骨架结合的能力,这些脂质体是由Philip Felgner开发的,他现在是加州大学尔湾分校疫苗研发中心的负责人)。但是,Cullis团队开发的可电离脂质能在生理条件(例如血液中的条件)下转化为中性电荷,这能限制LNP对身体的毒性作用。
后来LNP技术经过发展和升级,逐步成为了mRNA药物最适合的递送工具,现在几乎所有的mRNA疫苗开发公司都使用LNP或LNP的变体进行递送。
谁应该获得诺贝尔奖?
距离2021年诺贝尔奖公布的日期不到一周,如果诺贝尔奖花落mRNA疫苗技术,Karikó和Weissman无疑是最热门的人选。二人已经获得了多个奖项,包括科学突破奖、西班牙阿斯图里亚斯公主奖以及拉斯克奖。
而包括Malone在内的其他参与mRNA开发的人认为他们也应该得到更多的认可,如果将mRNA疫苗递送技术也算在内,做出关键贡献的人就更多了。
现在我们又回到了每年诺奖颁发时都会被“诟病”的问题:诺奖的人数实在是太有限了,得奖人数一般不会超过3人。一项世界瞩目的技术突破,从技术的诞生到发展有大量的研究人员去探索和完善,那究竟哪一环节的推进才算是最关键的突破呢?
你认为在mRNA疫苗技术的开发中谁该获得诺贝尔奖呢?
如果不是mRNA技术,你觉得哪项技术或发现会斩获今年的诺贝尔生理学或医学奖呢?
参考资料:
[1] The tangled history of mRNA vaccines(来源:Nature)
[2] 自述遭导师欺凌,被迫退出学术界,他认为自己才是发明mRNA疫苗的人(来源:科研圈)
[3] Wolff J.A., Malone R.W., Williams P, et al. Direct Gene Transfer into Mouse Muscle in Vivo. Science (1990)
[4] Buschmann M.D., Carrasco M.J., Alishetty S., et al. Nanomaterial Delivery Systems for mRNA Vaccines. Vaccines (2021)


