君实/礼来双抗体疗法历经波折
曾因对变异毒株无效被喊停
埃特司韦单抗(JS016)是一款重组全人源抗SARS-CoV-12单克隆中和抗体,用于治疗和预防COVID-19。JS016由君实生物与中科院共同针对新冠病毒开发。2020年5月,JS016的海外权益授权给礼来制药。海外授权后,由于国外新冠肺炎疫情局势的紧张,双抗体疗法顺利地打入市场,然而在进入市场使用后却经历了一番波折——
2020年6月,JS016作为全球首个在健康志愿者中开展临床试验的新冠病毒中和抗体在中美进入临床试验。
2020年11月,礼来就埃特司韦单抗和巴尼韦单抗双抗体治疗轻中度新型冠状病毒肺炎高风险患者向FDA提交了紧急使用授权申请。
2021年1月,君实生物宣布,埃特司韦单抗 2800 mg和巴尼韦单抗 2800 mg双抗体治疗显著降低了被确诊为COVID-19高重症化风险患者COVID-19相关住院和死亡事件。
2021年2月,双抗体疗法在美国和意大利获得紧急使用授权,用于治疗伴有进展为重度 COVID-19 和 / 或住院风险的轻重度 COVID-19 患者。美国政府向礼来采购了至少10万剂价值2.1亿美元的双抗体疗法用药。
6月25日,有媒体报道,美国公卫卫生与服务部宣布将停止分发礼来/君实的新冠中和抗体鸡尾酒双抗体疗法。
6月28日,君实生物紧急发布澄清公告称,美国政府所发布暂停供应双抗体疗法并非撤回其在美国的紧急使用授权。
8月27日,FDA及应急准备与反应助理部长办公室(ASPR)恢复双抗体疗法在部分耐药突变型流行率较低的地区恢复了该双抗体疗法的分发;9月2日,该双抗体疗法在美国全境的运输和分发,不再包含使用限制。
9月15日,美国政府又追加采购了价值3.3亿美元的38.8万剂埃特司韦单抗。
9月16日,君实/礼来新冠中和抗体鸡尾酒双抗体疗法紧急使用授权范围扩大,增加用于特定人群的暴露后预防(PEP)。
值得注意的是,6月28日,受到双抗体疗法在美暂停供应消息影响,君实生物科创板以及港股股价均受到冲击。科创板开盘大跌,股价一度跌超4%,收盘报跌2.11%;港股方面,君实生物下午开盘即大跌10.04%,收盘跌幅收窄至3.6%。
据悉,该双抗疗法在美暂停供应的原因是,美国疾控中心(CDC)监测到新冠病毒的P.1/Gamma突变型(新冠病毒Gamma变异毒株,最先于巴西确认),及B.1.351/Beta突变型(新冠病毒Beta变异毒株,最先于南非确认)在美国的总比例已超过11%,并呈上升趋势。而体外分析试验结果显示,君实/礼来的双抗体疗法对上述两种病毒突变株均不有效。
不过,幸运的是,考虑到双抗体疗法在假病毒及真病毒试验中显示出对Delta等突变型均保持了中和活性,而且6月以来,Delta突变型(B.1.617.2)在美国乃至全球的感染人群比例呈持续上升趋势,截至8月底,Delta突变型占美国所有已确诊新冠病例的近96%。君实/礼来的双抗体疗法也因此得以从“冷宫”中释放。
埃特司韦单抗对不同变异毒株的中和效力
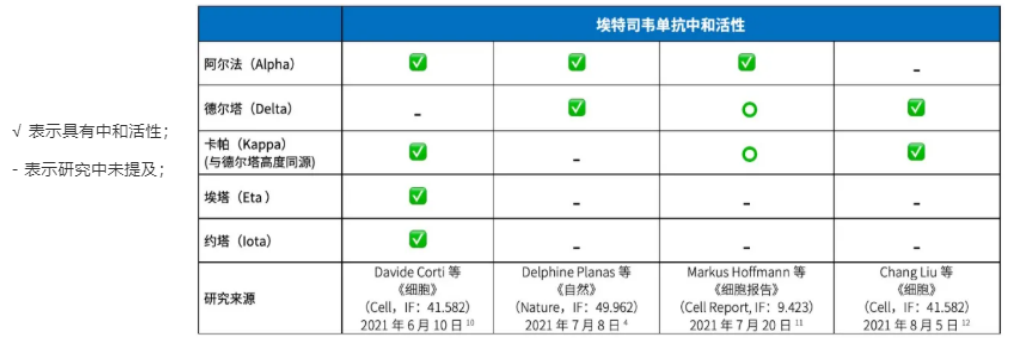
图源:申万宏源研究所

图源:申万宏源研究所
截至目前,埃特司韦单抗和巴尼韦单抗双抗体疗法已经在全球超过12个国家和地区获得紧急使用授权,覆盖欧、美、亚、非四大洲。
中和双抗市场表现优异
入局者“纷至沓来”
目前FDA已批准(包括EUA)上市用于新冠肺炎治疗的疗法已经达到11种。其中仅有吉利德的瑞德西韦为正式获批用于新冠肺炎患者治疗药物。
美国FDA目前批准(包括EUA)的新冠肺炎药物情况
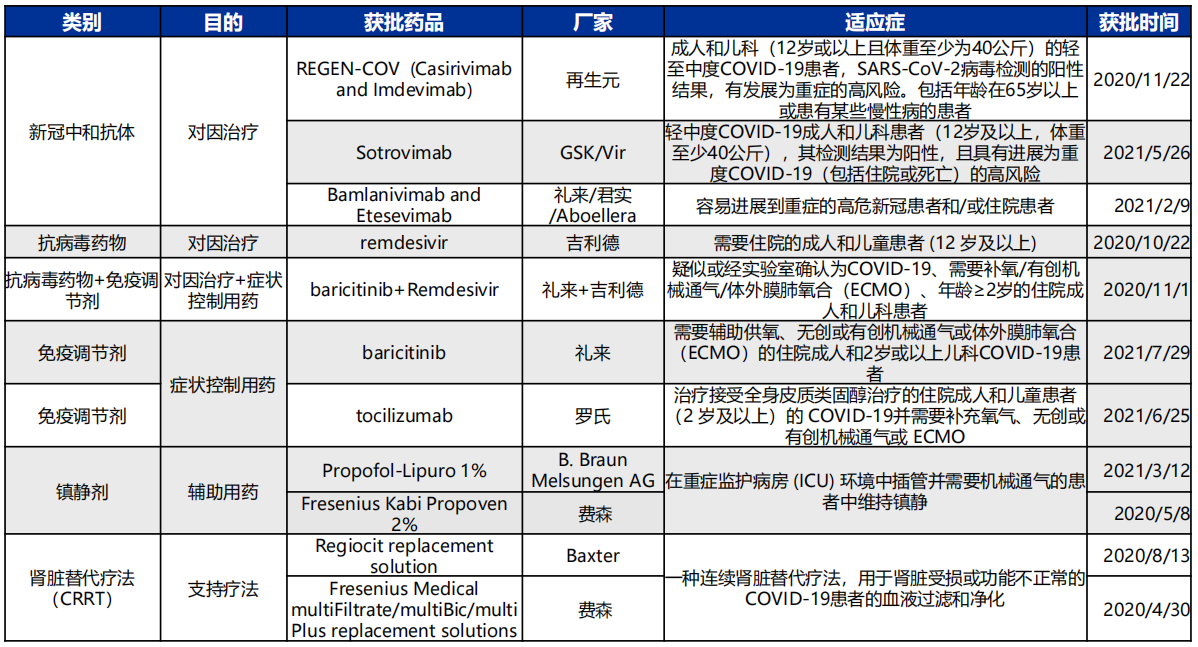

图源:申万宏源研究所
其余可使用的均和君实/礼来的双抗体疗法一样,仅获得紧急使用授权,其中新冠中和抗体药物具体还包括:再生元/罗氏的REGN-COV2(casirivimab+ imdevimab )和Vir/GSK的Sotrovimab。其中,除了GSK的sotrovimab外,均采用2种抗体组成的鸡尾酒疗法,主要为了应对变异毒株耐药风险。
获FDA授予EUA用于新冠肺炎的中和抗体药物
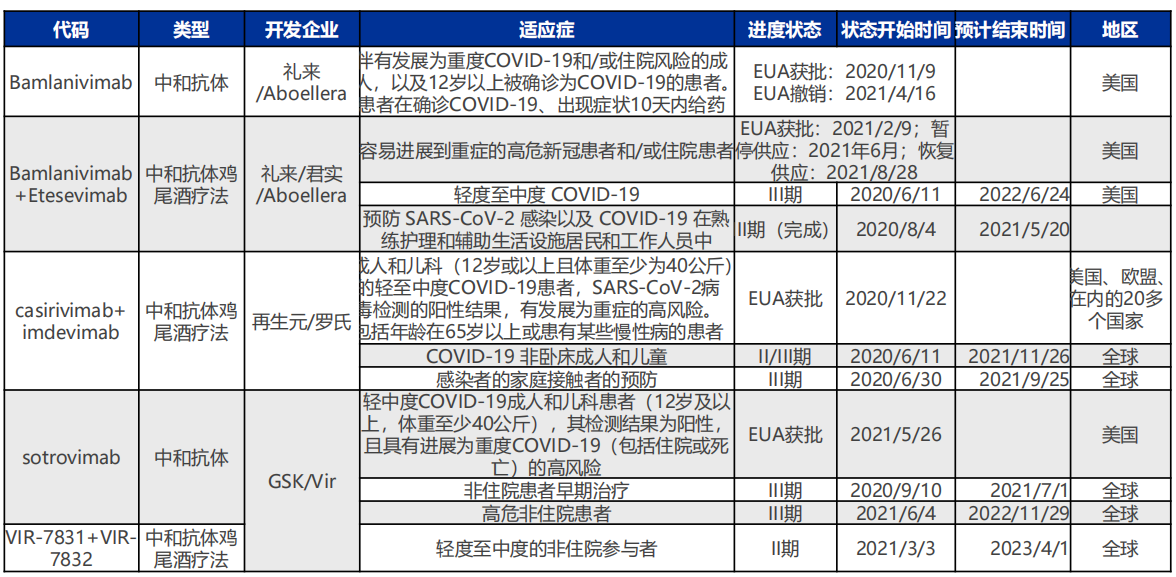

图源:申万宏源研究所
根据各企业发布的财报显示,礼来新冠病毒中和抗体上半年收入达9.59亿美元,占比总收入(135.46亿美元)7.08%;再生元今年第二季度营收51.4亿美元,来自新冠中和抗体REGEN-COV收入为27.6亿美元,占比超五成;Vir/GSK的Sotrovimab于今年5月获得FDA授予的EUA,目前暂未有销售数据披露。
通过财报数据,不难发现,疫情催生出的新冠“特效药”市场规模潜力巨大。兴业证券分析报告分析称,2020年底,预计中和抗体的商业化市场空间约18.3亿-38.4亿美元,2021年末,预计中和抗体的市场空间可达68.7亿-146.4亿美元。其中欧美发达国家市场空间更大,达到54.3亿-110.4亿美元;发展中国家市场规模约14.4亿-36亿美元。
面对巨大的市场诱惑,国内外大大小小的药企纷纷入局新冠中和抗体。据Antibody Therapeutics数据库统计,截至2020年9月,全球共有98个靶向新冠病毒S蛋白的中和抗体项目。在这之中,已有20款中和抗体药物获批临床。
阿斯利康AZD7442 ——全球首个长效新冠中和抗体鸡尾酒疗法
AZD7442由2种来自SARS-CoV-2感染的恢复期患者的单克隆抗体组成,通过靶 向病毒刺突蛋白的RBD结合域,阻止病毒进入人体细胞。范德比尔特大学医学中心于2020年6月授权给了阿斯利康,目前正在开展3项全球多中心的III期临床。2021/8/20日,阿斯利康公布AZD7442显 示对成人 COVID-19 的暴露前预防有效,已经启动在相关的EUA申请。
诺华DARPin蛋白疗法——“分子中的鸡尾酒”,单药靶向多位点
2020年10月诺华与Molecular Partners达 成 合 作,共同开发 2款针对COVID-19的DARPin蛋白疗法。该疗法通过“分子中的鸡尾酒”机制提供了一种差异化的治疗COVID-19的方法:以同时与SARS-CoV-2病毒的3个部位结合,通过多种机制中和病毒,并减少了发生病毒耐药的可能性。目前该疗法共2项III期临床在开展。
……
据不完全统计,目前国内在研治疗新冠中和抗体药物至少有10款。除了君实生物和中科院微生物所联合开发的JS016。还有两家企业已经进入III期临床,包括开拓药业的普克鲁胺以及腾盛博药的两款中和抗体BRII-196和BRIII-198。此外,迈威生物的MW33、神州细胞的SCTA01、绿叶制药LY-CovMab、复宏汉霖HLX70、济民可信JMB2002等进入临床试验阶段。
开拓药业普克鲁胺——在巴拉圭拿到全球首个住院患者EUA授权
普克鲁胺通过抑制雄激素受体功能,从转录水平下调ACE2 和TMPRSS2 的表达,进而阻断 SARS-CoV-2进入宿主细胞。2021年5月,获批在美国开展门诊患者和住院患者的III期临床。预计2021年Q4,针对covid-19的轻、中度门诊患者的美国III期临床将完成。2021年7月16日,巴拉圭国家公共卫生和社会福利部(MSPBS)正式授予普克鲁胺紧急使用授权 ,用于MSPBS医院系統COVID-19住院患者的治疗。
腾盛博药BRII-196/BRII-198——美国III期临床中期数据展现良好效果
BRII-196/BRII-198是在2020年初我国疫情进展期间,由清华大学和深圳市第三人民医院从新冠恢复期患者的血清中分离获得的高效中和性抗体,两种抗体结合于RBD没有竞争的两个靶点,同时通过Fc修饰,延长半衰期,从21天提高到最长3个月。目前一期及二期临床试验数据显示BRII-196/BRII-198具有良好的安全性及耐受性。8月25日公司公告了ACTIV-2试验的中期分析数据,在837例疾病进展高风险的新冠肺炎门诊患者中,与安慰剂相比,住院及死亡的复合终点降低78%,具有统计学显著性。预计今年第四季度,将提交EUA上市申请。
……
目前,全球疫情短时间内还不能消散,未来对新冠“特效药”的需求也不会立刻削减,而这其中也必然要有中和抗体的一席之地。
参考来源:申万宏源研报


