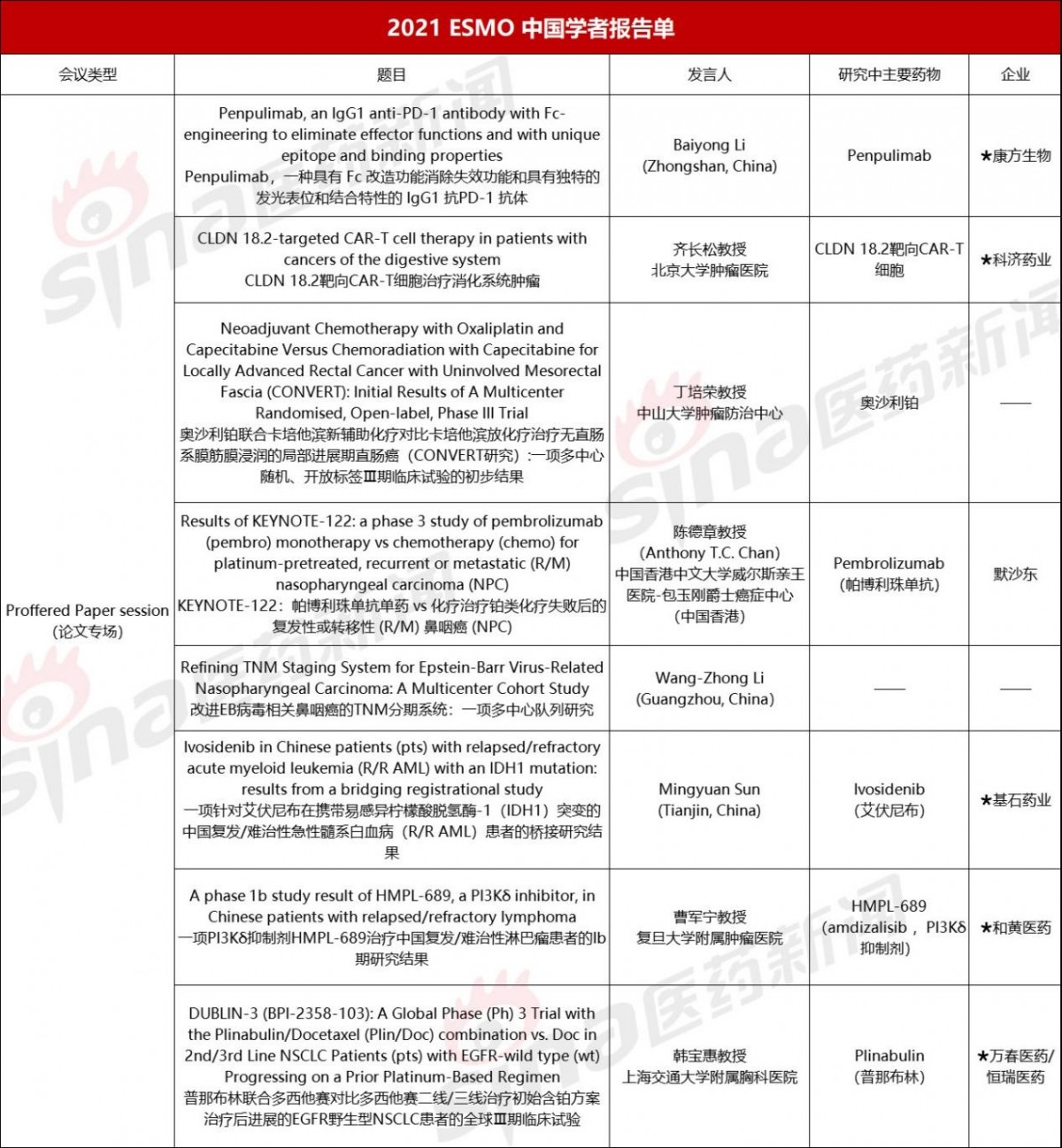
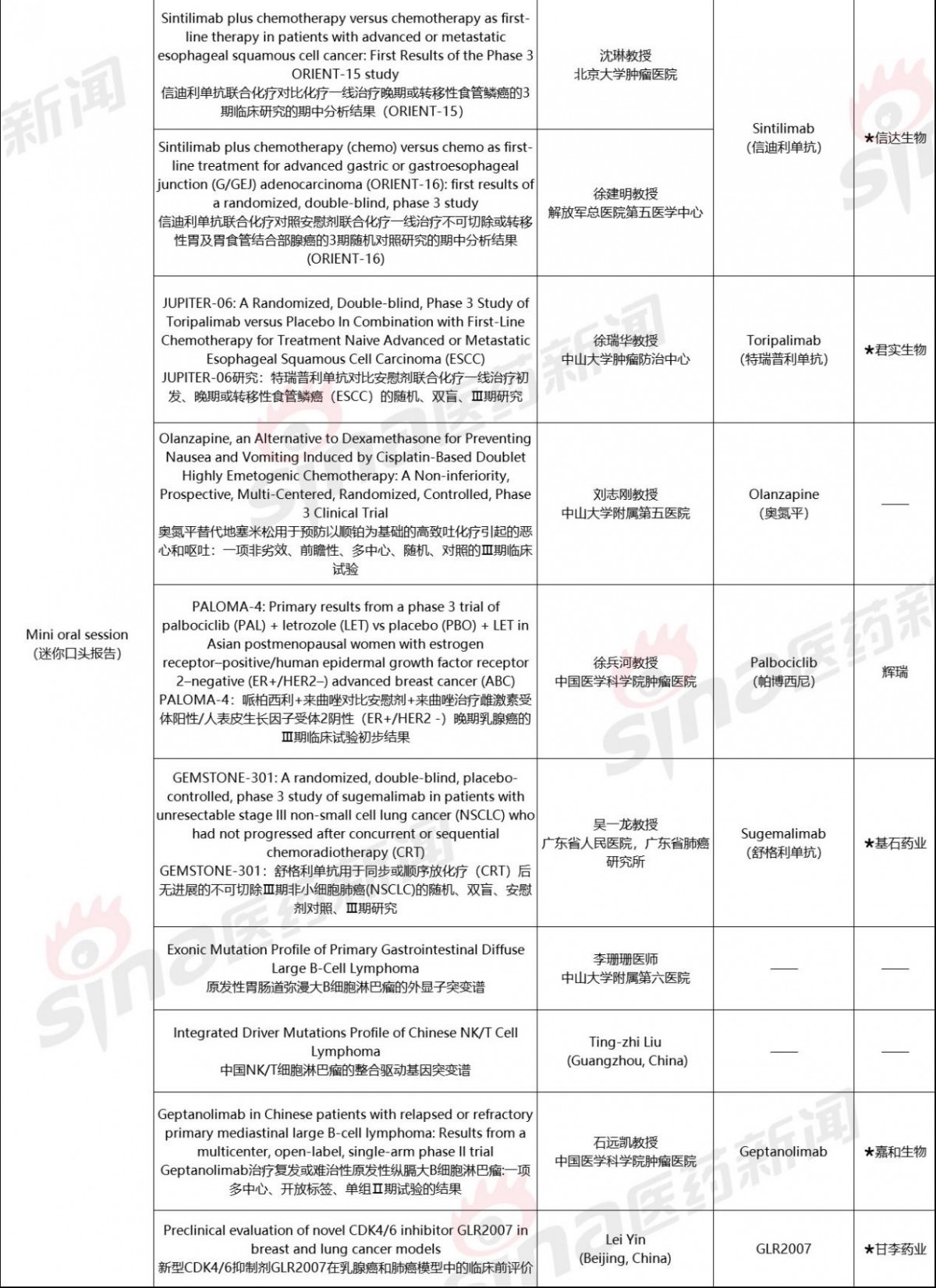
据不完全统计,国内药企入选本届ESMO年会的口头报告10余项,入选电子壁报展示近50项。其中,口头报告入选最多的是信达生物和基石药业,各2项,电子壁报展示入选最多的是恒瑞医药和百济神州,分别入选13项和5项。
此外,研究中涉及创新疗法以PD-1单抗居多,达到了6款药物(5款国产自研,一款为默沙东的帕博利珠单抗),7项研究(其中信达生物的信迪利单抗占两项研究)。其中除了来自默沙东的帕博利珠单抗
本文将针对本届大会中的口头报告项目,选取部分国内企业研究成果,结合大会披露信息以及各公司新闻稿进行整理,向读者分享。
01 信达生物
信达生物:Sintilimab(信迪利单抗)
研究一:信迪利单抗联合化疗对比化疗一线治疗晚期或转移性食管鳞癌的3期临床研究的期中分析结果(ORIENT-15)
研究二:信迪利单抗联合化疗对照安慰剂联合化疗一线治疗不可切除或转移性胃及胃食管结合部腺癌的3期随机对照研究的期中分析结果(ORIENT-16)
信达生物将在本届大会上公布多项临床数据,包括PD-1抑制剂信迪利单抗、抗CTLA-4单抗IBI310、FGFR 1/2/3抑制剂pemigatinib(IBI375)的多项临床数据。其中,信迪利单抗的食管癌和胃癌3期临床数据为论文口头报告形式,且为首次发表。
信迪利单抗是一种人类免疫球蛋白G4(IgG4)单克隆抗体,能特异性结合T细胞表面的PD-1分子,从而阻断导致肿瘤免疫耐受的PD-1╱程序性死亡受体配体1(Programmed Death-Ligand 1, PD-L1)通路,重新激活淋巴细胞的抗肿瘤活性,从而达到治疗肿瘤的目的。信达生物正在进行有关该药物的20多项临床试验,除了已经获批的霍奇金淋巴瘤,还包括一线非鳞非小细胞肺癌、一线肺鳞癌等。
ORIENT-15研究是一项比较信迪利单抗联合化疗(顺铂+紫杉醇╱5-氟尿嘧啶)与安慰剂联合化疗一线治疗不可切除的局部晚期、复发性或转移性食管鳞癌患者的随机、双盲、国际多中心、III期研究(ClinicalTrials.gov, NCT03748134)。此前公司披露信息显示:截至期中分析,该研究已入组659例受试者,受试者将按1:1比例随机进入试验组或对照组。主要研究终点为总体人群的总生存期和PD-L1阳性(CPS≥10)人群的总生存期。
ORIENT-16研究是一项比较信迪利单抗联合化疗(奥沙利铂+卡培他滨)与安慰剂联合化疗一线治疗不可切除的局部晚期、复发性或转移性胃或胃食管交界处腺癌的随机、双盲、多中心III期临床研究。不久前,信达生物宣布该试验达到主要研究终点:基于独立数据监察委员会(iDMC)进行的期中分析,对于意向治疗分析(ITT)人群和PD-L1阳性人群,信迪利单抗联合化疗对比安慰剂联合化疗均显著延长了患者的总生存期(OS),达到预设的优效性标准,安全性特征与既往报道的信迪利单抗相关临床研究结果一致,无新的安全性信号。
02 基石药业
基石药业:Sugemalimab(舒格利单抗)、Ivosidenib(艾伏尼布)
研究一:GEMSTONE-301——舒格利单抗用于同步或顺序放化疗(CRT)后无进展的不可切除Ⅲ期非小细胞肺癌(NSCLC)的随机、双盲、安慰剂对照、Ⅲ期研究
研究二:一项针对艾伏尼布在携带易感异柠檬酸脱氢酶-1(IDH1)突变的中国复发/难治性急性髓系白血病(R/R AML)患者的桥接研究结果
同样入选两项口头报告的还有基石药业,这两项研究分别针对舒格利单抗和艾伏尼布。
舒格利单抗是由基石药业基于OmniRat®转基因动物平台开发抗PD-L1单克隆抗体。作为一种全人源全长抗PD-L1单克隆抗体,舒格利单抗是一种最接近人体的天然G型免疫球蛋白4 (IgG4) 单抗药物,在患者体内产生免疫原性及相关毒性的风险更低。目前,基石药业已向国家药监局递交舒格利单抗治疗局部晚期/不可切除(III期)NSCLC的新药上市申请。此外,舒格利单抗治疗转移性(IV期)NSCLC的新药上市申请已于去年获国家药监局受理,目前正在审评中。
GEMSTONE-301研究是一项多中心、随机、双盲的III期临床试验,旨在评估舒格利单抗作为巩固治疗在同步或序贯放化疗后未发生疾病进展的、局部晚期/不可切除的III期NSCLC患者中的有效性和安全性。期中分析表明,舒格利单抗作为巩固治疗,显著改善盲态独立中心审阅(BICR)评估的无进展生存期(PFS),差异具有统计学显著性与临床意义。舒格利单抗的安全性良好,未发现新的安全性信号。亚组分析显示,无论是试验前接受同步还是序贯放化疗的患者均显示出临床获益。
艾伏尼布是一款IDH1抑制剂,通过阻断IDH1突变体酶的活性,可促进AML细胞的分化,从而发挥抗肿瘤效应。艾伏尼布最早由 Agios公司开发。2018年,艾伏尼布在美国获FDA批准,用于治疗携带IDH1易感突变的成人复发或难治性急性髓系白血病患者。施维雅公司拥有其在美国地区的商业化权益。国内方面基石药业于2018年获得艾伏尼布中国的商业化授权,并展开了注册研究CS3010-101。目前,国家药监局已受理艾伏尼布的新药上市申请并被纳入优先审评,用于治疗携带IDH1易感突变的成人复发或难治性急性髓系白血病患者。
CS3010-101中国桥接研究是一项正在中国进行的I期、多中心、单臂研究。该研究旨在评估艾伏尼布口服治疗携带易感IDH1突变的成人R/R AML患者的药代动力学(PK)特征、药效动力学(PD)特征、安全性和临床疗效,并作为全球关键性研究AG120-C-001的桥接研究,提供中国R/R AML患者数据。今年7月,艾伏尼布在中国的注册桥接研究CS3010-101达到预期终点,在携带易感IDH1突变的中国R/R AML患者中,艾伏尼布显示了明确的疗效和可控的安全性,且与全球研究人群中的疗效和安全性数据基本一致。
03 君实生物
君实生物:Toripalimab(特瑞普利单抗)
研究:JUPITER-06研究:特瑞普利单抗对比安慰剂联合化疗一线治疗初发、晚期或转移性食管鳞癌(ESCC)的随机、双盲、Ⅲ期研究
君实生物的特瑞普利单抗是一款重组人源化抗PD-1单克隆抗体注射液,拥有独特的双重作用机制。该药已获得国家药监局批准多项适应症,涵盖黑色素瘤、鼻咽癌、尿路上皮癌。截至目前,特瑞普利单抗已在全球开展了30多项临床研究,涵盖黑色素瘤、鼻咽癌、尿路上皮癌、肺癌、胃癌、食管癌、肝癌、胆管癌、乳腺癌、肾癌等适应症。
JUPITER-06是一项随机、双盲、安慰剂对照、多中心的Ⅲ期临床研究,旨在比较特瑞普利单抗联合紫杉醇/顺铂与安慰剂联合紫杉醇/顺铂在晚期或者转移性食管鳞癌的一线治疗的疗效和安全性。研究实际入组 514 例患者,该研究的主要研究终点为盲态独立评审委员会(BICR)评估的无进展生存期(PFS)和总生存期(OS),次要研究终点包括研究者评估的 PFS 以及客观缓解率(ORR)、疾病控制率(DCR)和疗效持续时间(DOR)等。
根据期中分析结果,独立数据监察委员会(IDMC)判定该研究两个主要研究终点无进展生存期和总生存期都达到方案预设的优效界值,结果表明特瑞普利单抗联合紫杉醇/顺铂一线治疗晚期或转移性食管鳞癌患者,较紫杉醇/顺铂的标准一线治疗,可显著延长患者的无进展生存期和总生存期。
04 科济药业
科济药业:CLDN18.2 CAR-T
研究:CLDN 18.2靶向CAR-T细胞治疗消化系统肿瘤
本届ESMO年会中CAR-T疗法研究同样备受关注。科济药业自主研发的CT041自体CAR T细胞注射液,是采用人源化抗体靶向Claudin18.2(CLDN18.2)的嵌合抗原受体(CAR)修饰的T细胞,主要目标适应症为CLDN18.2表达阳性、既往经系统治疗后出现进展或复发的晚期胃腺癌/食管胃结合部腺癌、胰腺癌。
CLDN 18.2是 Claudin-18 的一种胃特异性异构体,在胃腺癌和胰腺腺癌中高度表达,科济生物与上海市肿瘤研究所联合开发了国际上首个针对 Claudin18.2 的 CAR-T 细胞,并在小鼠模型中证明,CLDN18.2靶向的CAR-T细胞可以在小鼠体内高效清除胃腺癌,且具有很好的安全性,有望成为胃腺癌等肿瘤的新治疗手段。
上半年,科济生物宣布,人源化抗Claudin18.2(CLDN18.2)自体CAR T细胞注射液(CT041)用于治疗CLDN18.2表达阳性、既往经系统治疗后出现进展或复发的晚期胃腺癌/食管胃结合部腺癌、胰腺癌的新药临床试验(IND)申请,获得美国国家食品药品监督管理局(FDA)许可,成为国际上首个获得临床试验许可的针对CLDN18.2的CAR-T细胞候选药品。
目前,科济药业已在中国启动了一项针对晚期胃癌/胃食管结合部癌和胰腺癌的1b/2期临床试验,以及在美国启动了一项针对晚期胃癌或胰腺癌的1b期临床试验。在正在进行的临床试验中,CT041表现出较好治疗效果及良好的安全性。
可以发现本届大会精选的一众重磅研究成果,涵盖了单抗、CAR-T产品、小分子抑制剂等许多创新疗法,国内药企将携这些研究在国际舞台上大放异彩。当然,除了上文中提到的研究外,本次大会其他未能整理到的国内外研究一样不容小觑。未来几日,新浪医药(sinayiyao)将持续关注!
参考来源:信达生物、基石药业、君实生物、科济药业官网及公告


