在国内,拥有mRNA概念的艾博生物也在时隔不到4个月的时间内就完成一笔总金额超过7亿美元的C轮融资,刷新中国生物医药公司IPO前的单笔融资纪录。开拓药业在治疗新冠药物普克鲁胺的带动下股价一路上涨,从7元涨到了77元......
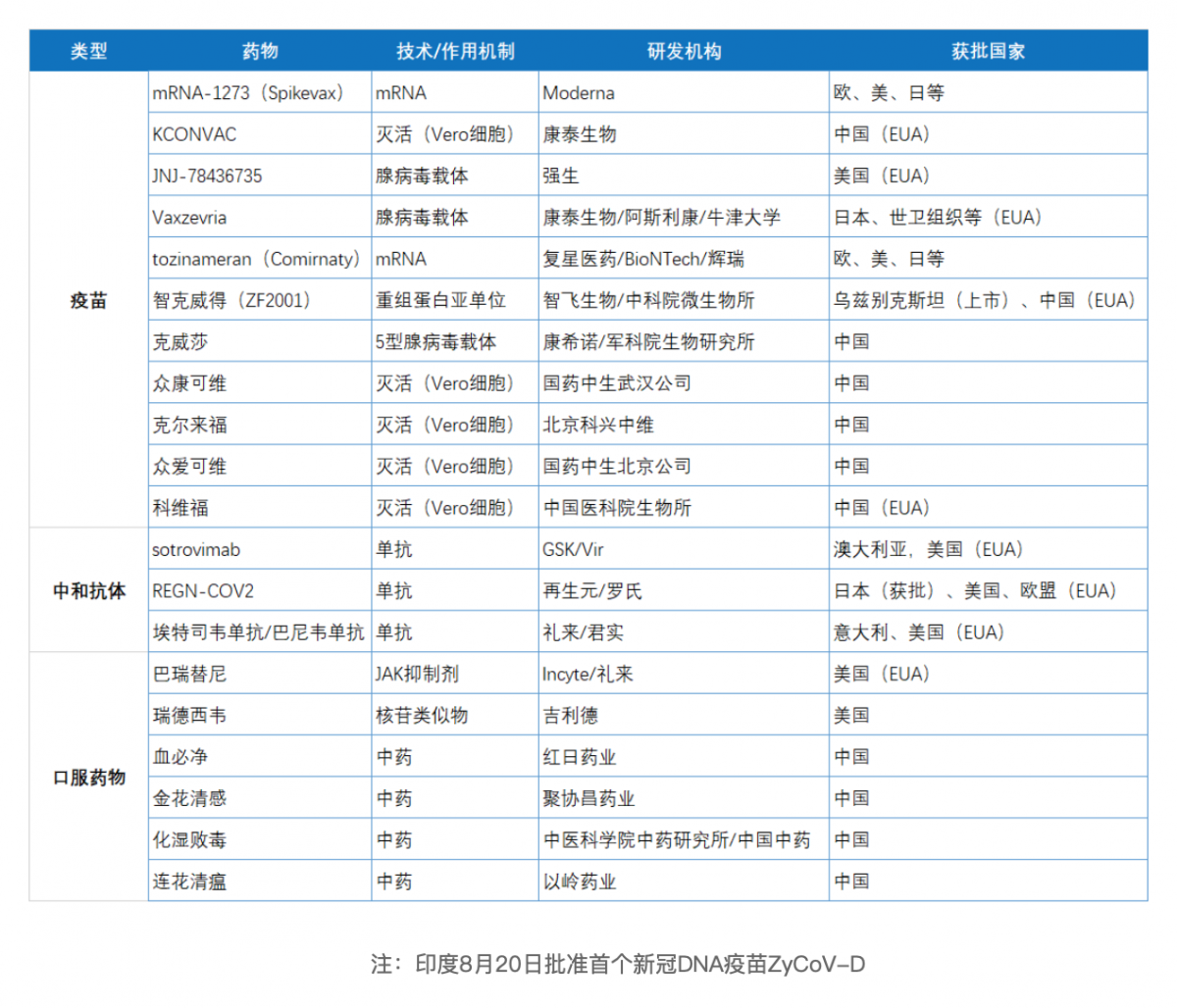
根据医药魔方NextPharma数据库,目前在中美欧日等国家获得监管机构批准、紧急使用授权(EUA)/临时供应的用于预防/治疗新冠疾病相关的药物多达20款,其中疫苗共11款,中和抗体3款,其他产品6款。
中美欧日用于防治新冠的药物

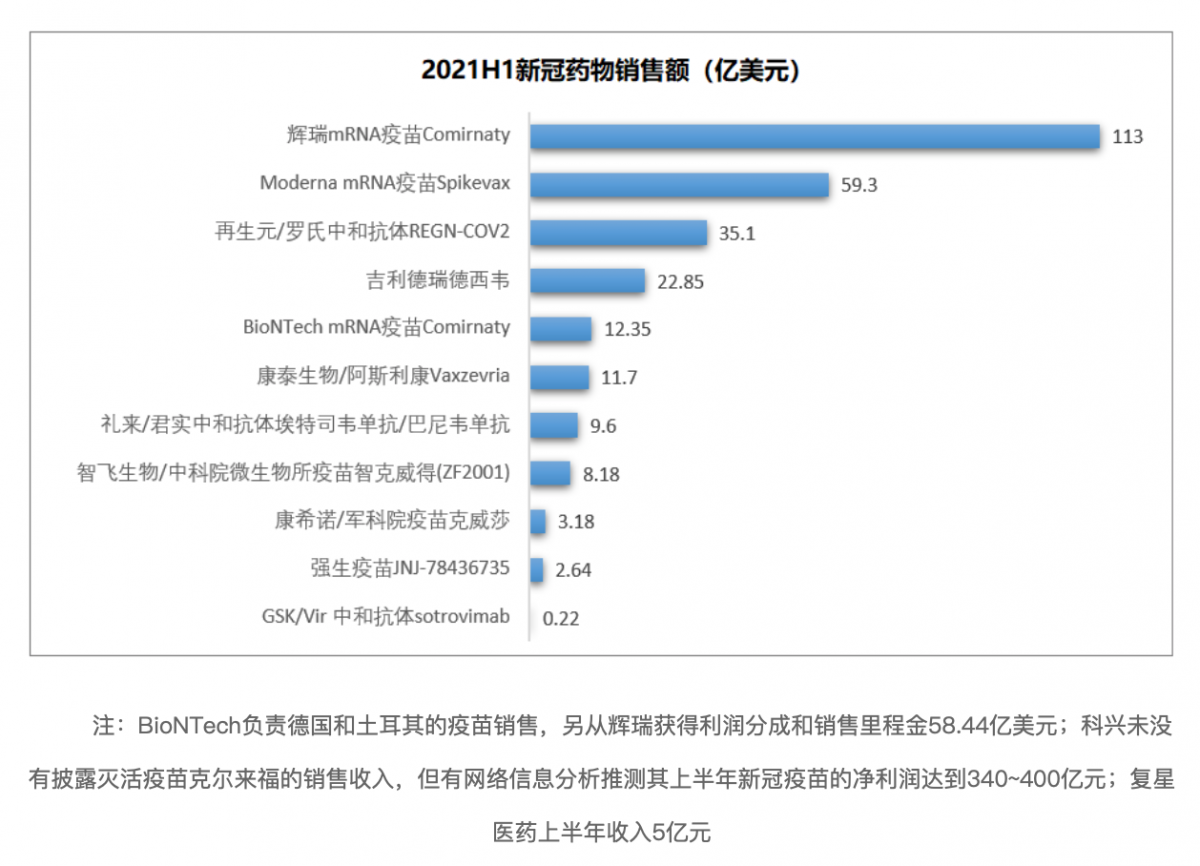
从企业披露的年中业绩来看,这些新冠药物的2021上半年销售收入合计为278亿美元(不包括国药中生、北京科兴中维)。疫苗方面,辉瑞mRNA疫苗销售收入113亿美元,Moderna销售收入59.3亿美元,阿斯利康/康泰生物11.7亿美元,智飞生物8.18亿美元(53亿元),康希诺3.18亿美元(20.6亿元),强生2.64亿美元。中和抗体方面,罗氏/再生元35.1亿美元、礼来/君实9.6亿美元(美国FDA已于近日恢复该产品在美国的分发,销售收入下半年有望大增)。GSK/Vir中和抗体0.22亿美元(0.16亿英镑)。口服药物中,吉利德的瑞德西韦销售收入22.85亿美元。
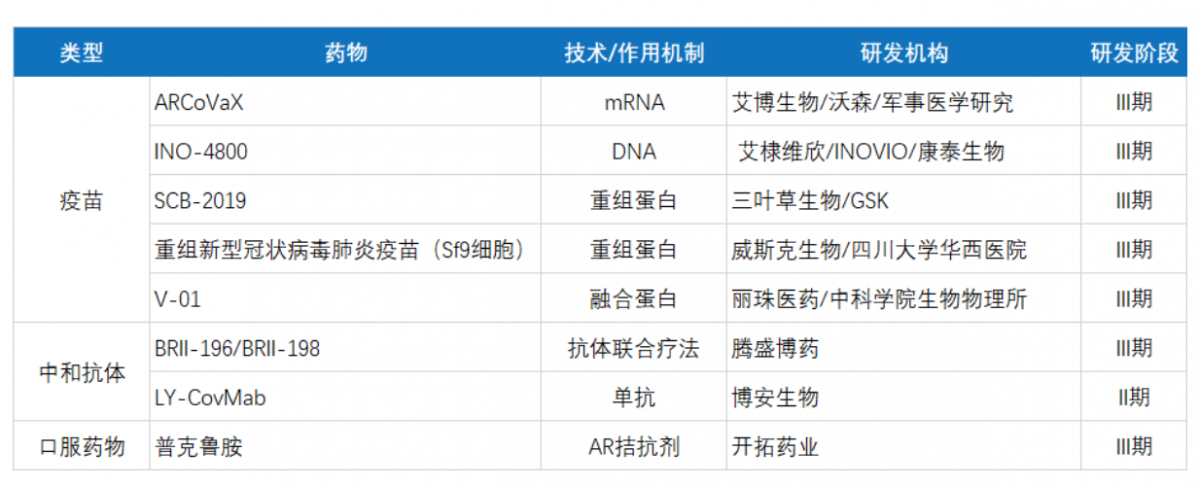
在如此诱人的市场回报之下,全球范围内的新冠治疗药物开发自然也是如火如荼,包括多家中国公司的疫苗、中和抗体、口服药物项目也同样在加速向III期和上市的目标推进。
中国部分在研新冠药物
艾博生物/沃森生物mRNA疫苗ARCoVaX
ARCoVaX最初由艾博生物开发,2020年5月11日沃森生物与艾博生物就共同开发该款疫苗达成合作。ARCoVaX由脂质纳米粒包裹,靶向SARS-CoV-2棘突蛋白RBD区域。100μg剂量可诱导高水平中和抗体,1000μg剂量无明显的不良反应。单剂或两剂ARCoV免疫可在小鼠和非人类灵长类动物中激发抗多种流行SARS-CoV-2毒株的强大抗体和T细胞应答。艾博生物/沃森生物已于今年5月在国外开展ARCoVaX的III期临床研究,并于今年7月21日在中国开展III期临床。
INOVIO/艾棣维欣DNA疫苗INO-4800
INO-4800由艾棣维欣与INOVIO合作开发。艾棣维欣拥有INO-48001在大中华地区的独家开发、制造和商业化权利。前期实验数据显示INOVIO具有优秀的安全性和免疫原性,均衡的体液及细胞免疫反应。此外,DNA疫苗在稳定性及产能等方面也具有产业化优势。
今年1月4日,美国INOVIO公司和艾棣维欣就INO-4800达成进一步合作和许可协议,根据协议,艾棣维欣授权INOVIO使用DNA疫苗的大规模生产制备工艺技术与专利,供其在全球范围内生产新冠DNA疫苗以及其他候选疫苗产品,并授予INOVIO制药向其他境外CDMO等生产合作伙伴进行分许可的权利,用于量产新冠DNA疫苗。目前该款疫苗已启动全球多中心III期临床研究。
三叶草重组蛋白新冠疫苗SCB-2019
SCB-2019是三叶草生物应用Trimer-Tag©(蛋白质三聚体化)技术平台开发出SCB-2019抗原(一种基于SARS-CoV-2病毒S蛋白的稳定三聚体结构融合蛋白)并添加CpG 1018佐剂及氢氧化铝佐剂的重组蛋白新冠疫苗。
SCB-2019的全球关键性II/III期临床试验SPECTRA在7月6日按计划完成了中年和老年受试者的入组,预计在2021年第三季度发布疫苗有效性数据并向EMA、NMPA、WHO提交附条件批准申请。今天6月30日,全球疫苗免疫联盟 (Gavi) 已经与三叶草生物签订了4.14 亿剂的重组蛋白新冠候选疫苗供货协议。
丽珠医药重组新型冠状病毒融合蛋白疫苗V-01
V-01自2020年7月开始立项研发,是丽珠医药旗下丽珠单抗与中国科学院生物物理研究所合作研发的创新型新冠重组蛋白疫苗。丽珠单抗于近日向菲律宾FDA提交的III期临床试验申请已获批准,并于2021年 8 月25日在菲律宾成功完成首例受试者入组,目前,丽珠单抗已向全球10余个国家提交了III期临床试验申请。
腾盛博药中和抗体BRII-196/BRII-198
BRII-196和BRII-198是从康复期的COVID-19患者中获得的非竞争性SARS-CoV-2单克隆中和抗体,特别应用了基因工程技术以降低抗体介导依赖性增强作用的风险,以及延长血浆半衰期以获得更持久的治疗效果。它们的非重叠表位结合区提供了针对SARS-CoV-2的高度中和活性,初步的体外证据表明它们对最初发现于英国、南非、巴西和印度普遍流行的病毒变异株具有持续的抗病毒活性。
BRII-196/BRII-198联合疗法的中国II期试验正在进行中,由钟南山院士牵头。8月5日,腾盛博药宣布BRII-196/BRII-198联合疗法III期ACTIV-2研究已在美国、巴西、南非、墨西哥和阿根廷的研究中心完成846位受试者的入组工作。
博安生物中和抗体LY-CovMab
LY-CovMab由博安生物的全人抗体转基因小鼠及噬菌体展示技术平台开发,临床前药效学研究结果显示LY-CovMab在治疗及预防SARS-CoV-2感染方面均具有良好疗效,同时能有效应对病毒突变。此外,得益于特殊的Fc序列设计,LY-CovMab能有效避免ADE效应(抗体依赖的增强作用)发生。在中国完成的I期临床研究已表现出该药物具有良好的安全性和耐受性。8月20日,绿叶制药集团宣布LY-CovMab已获准在中国开展II期临床,并计划在全球多个国家开展临床试验。
开拓药业普克鲁胺
普克鲁胺是开拓药业自主研发的新一代雄激素受体拮抗剂,具有竞争抑制AR和下调AR表达的双重机制,能够有效降低新冠病毒入侵宿主细胞的两个关键蛋白——ACE2和TMPRSS2的表达,从而抑制病毒感染宿主细胞,切断病毒的复制繁殖,达到治疗目的。同时,普克鲁胺可以通过激活Nrf2通路,从而促进病原体的清除和炎症的消退,进而激活多种抗氧化细胞并降低细胞因子风暴的强 度,使重症新冠患者临床获益。
5月18日,美国FDA已同意普克鲁胺用于治疗住院COVID-19患者的III期临床试验,这是开拓药业继普克鲁胺用于治疗轻中症COVID-19患者的III期临床试验之后第2个获得FDA同意的关键性全球多中心III期临床试验。
总之,新冠疫情是一场严峻的公共卫生挑战,但对于一些拥有技术和项目储备的公司却也是一场机遇,其命运在抗疫大战中被改变。在此也期望更多公司能够推出技术更多样的药物,帮助全球应对以及早日摆脱这场阴霾。
ARCoVaX最初由艾博生物开发,2020年5月11日沃森生物与艾博生物就共同开发该款疫苗达成合作。ARCoVaX由脂质纳米粒包裹,靶向SARS-CoV-2棘突蛋白RBD区域。100μg剂量可诱导高水平中和抗体,1000μg剂量无明显的不良反应。单剂或两剂ARCoV免疫可在小鼠和非人类灵长类动物中激发抗多种流行SARS-CoV-2毒株的强大抗体和T细胞应答。艾博生物/沃森生物已于今年5月在国外开展ARCoVaX的III期临床研究,并于今年7月21日在中国开展III期临床。
INOVIO/艾棣维欣DNA疫苗INO-4800
INO-4800由艾棣维欣与INOVIO合作开发。艾棣维欣拥有INO-48001在大中华地区的独家开发、制造和商业化权利。前期实验数据显示INOVIO具有优秀的安全性和免疫原性,均衡的体液及细胞免疫反应。此外,DNA疫苗在稳定性及产能等方面也具有产业化优势。
今年1月4日,美国INOVIO公司和艾棣维欣就INO-4800达成进一步合作和许可协议,根据协议,艾棣维欣授权INOVIO使用DNA疫苗的大规模生产制备工艺技术与专利,供其在全球范围内生产新冠DNA疫苗以及其他候选疫苗产品,并授予INOVIO制药向其他境外CDMO等生产合作伙伴进行分许可的权利,用于量产新冠DNA疫苗。目前该款疫苗已启动全球多中心III期临床研究。
三叶草重组蛋白新冠疫苗SCB-2019
SCB-2019是三叶草生物应用Trimer-Tag©(蛋白质三聚体化)技术平台开发出SCB-2019抗原(一种基于SARS-CoV-2病毒S蛋白的稳定三聚体结构融合蛋白)并添加CpG 1018佐剂及氢氧化铝佐剂的重组蛋白新冠疫苗。
SCB-2019的全球关键性II/III期临床试验SPECTRA在7月6日按计划完成了中年和老年受试者的入组,预计在2021年第三季度发布疫苗有效性数据并向EMA、NMPA、WHO提交附条件批准申请。今天6月30日,全球疫苗免疫联盟 (Gavi) 已经与三叶草生物签订了4.14 亿剂的重组蛋白新冠候选疫苗供货协议。
丽珠医药重组新型冠状病毒融合蛋白疫苗V-01
V-01自2020年7月开始立项研发,是丽珠医药旗下丽珠单抗与中国科学院生物物理研究所合作研发的创新型新冠重组蛋白疫苗。丽珠单抗于近日向菲律宾FDA提交的III期临床试验申请已获批准,并于2021年 8 月25日在菲律宾成功完成首例受试者入组,目前,丽珠单抗已向全球10余个国家提交了III期临床试验申请。
腾盛博药中和抗体BRII-196/BRII-198
BRII-196和BRII-198是从康复期的COVID-19患者中获得的非竞争性SARS-CoV-2单克隆中和抗体,特别应用了基因工程技术以降低抗体介导依赖性增强作用的风险,以及延长血浆半衰期以获得更持久的治疗效果。它们的非重叠表位结合区提供了针对SARS-CoV-2的高度中和活性,初步的体外证据表明它们对最初发现于英国、南非、巴西和印度普遍流行的病毒变异株具有持续的抗病毒活性。
BRII-196/BRII-198联合疗法的中国II期试验正在进行中,由钟南山院士牵头。8月5日,腾盛博药宣布BRII-196/BRII-198联合疗法III期ACTIV-2研究已在美国、巴西、南非、墨西哥和阿根廷的研究中心完成846位受试者的入组工作。
博安生物中和抗体LY-CovMab
LY-CovMab由博安生物的全人抗体转基因小鼠及噬菌体展示技术平台开发,临床前药效学研究结果显示LY-CovMab在治疗及预防SARS-CoV-2感染方面均具有良好疗效,同时能有效应对病毒突变。此外,得益于特殊的Fc序列设计,LY-CovMab能有效避免ADE效应(抗体依赖的增强作用)发生。在中国完成的I期临床研究已表现出该药物具有良好的安全性和耐受性。8月20日,绿叶制药集团宣布LY-CovMab已获准在中国开展II期临床,并计划在全球多个国家开展临床试验。
开拓药业普克鲁胺
普克鲁胺是开拓药业自主研发的新一代雄激素受体拮抗剂,具有竞争抑制AR和下调AR表达的双重机制,能够有效降低新冠病毒入侵宿主细胞的两个关键蛋白——ACE2和TMPRSS2的表达,从而抑制病毒感染宿主细胞,切断病毒的复制繁殖,达到治疗目的。同时,普克鲁胺可以通过激活Nrf2通路,从而促进病原体的清除和炎症的消退,进而激活多种抗氧化细胞并降低细胞因子风暴的强 度,使重症新冠患者临床获益。
5月18日,美国FDA已同意普克鲁胺用于治疗住院COVID-19患者的III期临床试验,这是开拓药业继普克鲁胺用于治疗轻中症COVID-19患者的III期临床试验之后第2个获得FDA同意的关键性全球多中心III期临床试验。
总之,新冠疫情是一场严峻的公共卫生挑战,但对于一些拥有技术和项目储备的公司却也是一场机遇,其命运在抗疫大战中被改变。在此也期望更多公司能够推出技术更多样的药物,帮助全球应对以及早日摆脱这场阴霾。


