8月5日,Artios Pharma在clinicaltrials网站公示了First in class药物ART4215的临床登记信息,ART4215也就成为全球首个进入临床研究的DNA聚合酶θ(Polθ/POLQ)抑制剂。

DNA聚合酶theta(Polθ或POLQ)是具有同源重组(HR,homologous recombination)缺陷的合成致死型靶点,在双链断裂 (DSB)的DNA损伤应答(DDR)途径中具有重要作用。DDR是近年国内外药企十分关注的领域,再鼎医药近期与Schrödinger宣布达成的合作也是针对肿瘤DNA损伤响应机制。
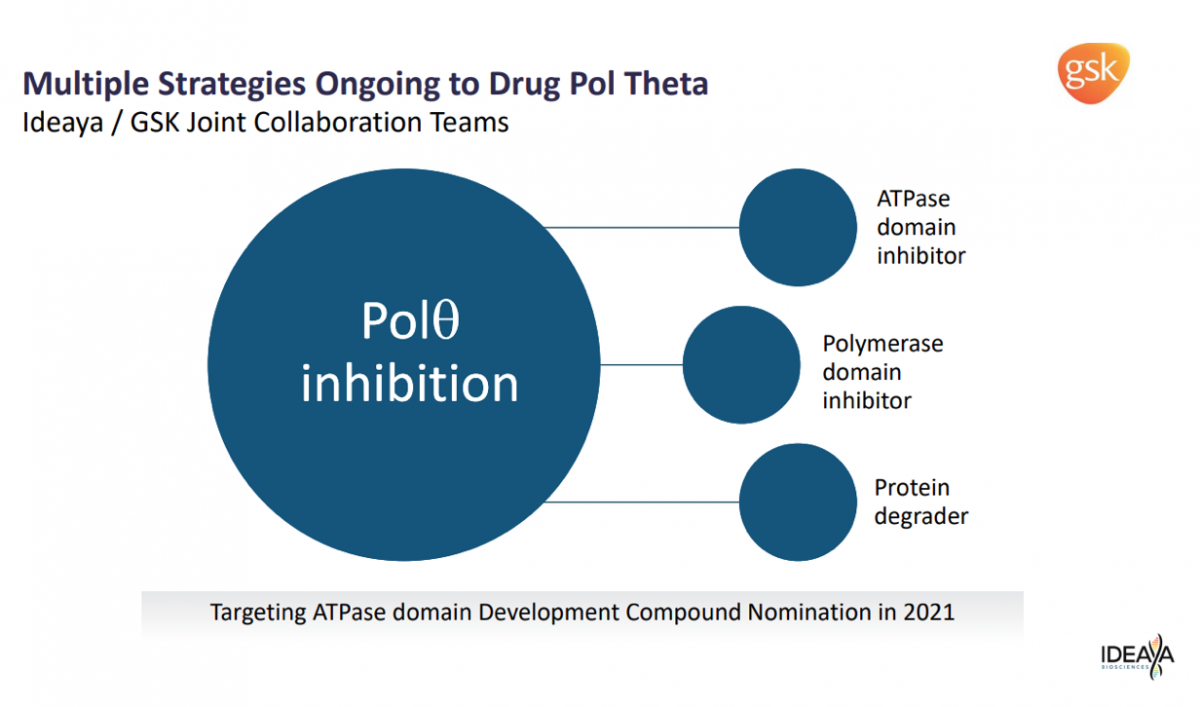
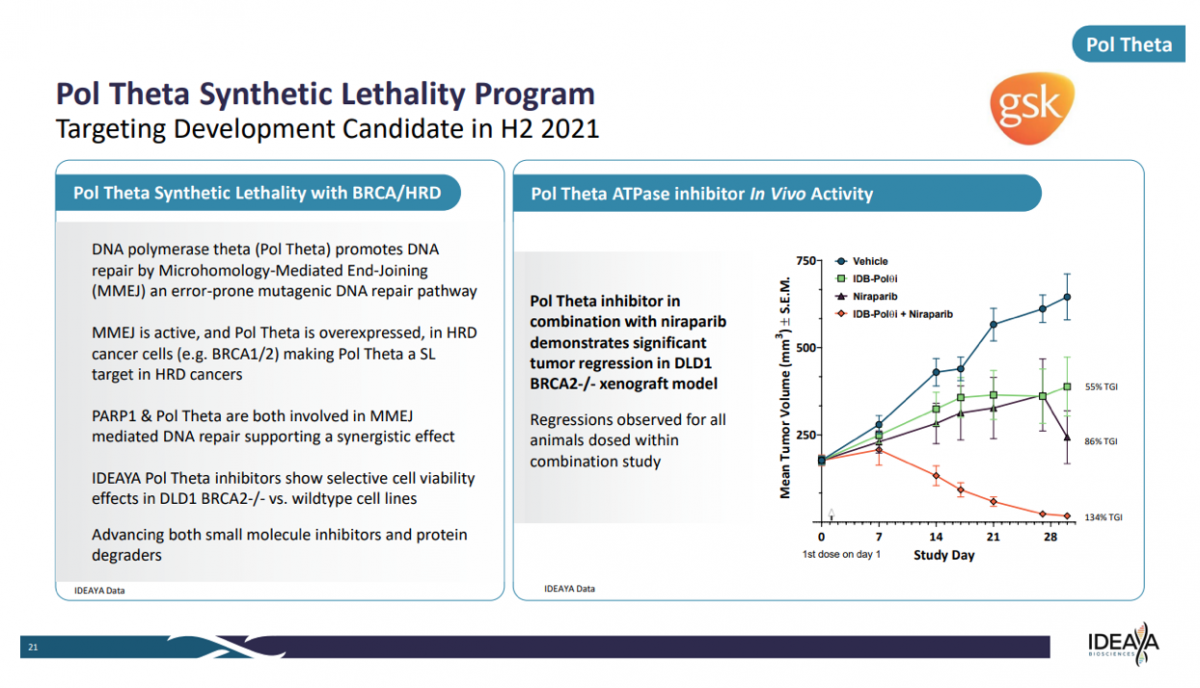
虽然,Polθ作为该领域备受关注的靶标,开发略显缓慢;不过,也是受到巨头频频关注。GSK曾与IDEAYA达成POLQ的开发协议,目前处于临床前阶段。
虽然,Polθ作为该领域备受关注的靶标,开发略显缓慢;不过,也是受到巨头频频关注。GSK曾与IDEAYA达成POLQ的开发协议,目前处于临床前阶段。
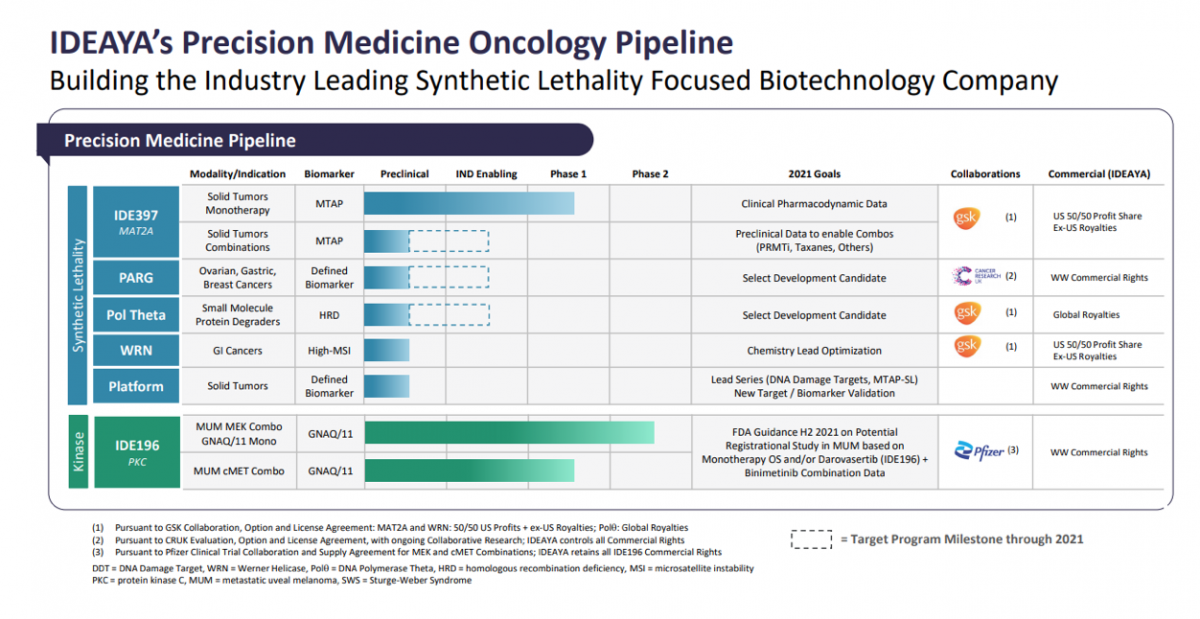
POLQ:DDR领域合成致死潜力靶标
合成致死(Synthetic lethality)的理论由来已久,最早可以追溯到1922年[1],PARP抑制剂奥拉帕尼是首个在临床和实践中获得概念性验证的合成致死药物。DNA聚合酶 theta(POLθ 或 POLQ)属于同源重组 (HR) 缺陷的合成致死范畴,因此,也就成了HR 缺陷癌症的候选靶标。
2003年,Shima N等发现小鼠Chaos1(染色体自发畸变1)突变导致Polq1基因中的主要氨基酸从丝氨酸变为脯氨酸,这一发现开启了Pol θ的研究起源[2]。此后,Wood实验室纯化了全长人源 Polθ,并证实它具有DNA合成和DNA依赖性ATP酶活性[3]。Polθ是人类基因组中15种 DNA聚合酶之一,包含一个C-末端A家族DNA聚合酶和N末端超家族2(SF2)型DNA解旋酶,中间由长且保守程度较低的未知功能中心域隔开。
合成致死(Synthetic lethality)的理论由来已久,最早可以追溯到1922年[1],PARP抑制剂奥拉帕尼是首个在临床和实践中获得概念性验证的合成致死药物。DNA聚合酶 theta(POLθ 或 POLQ)属于同源重组 (HR) 缺陷的合成致死范畴,因此,也就成了HR 缺陷癌症的候选靶标。
2003年,Shima N等发现小鼠Chaos1(染色体自发畸变1)突变导致Polq1基因中的主要氨基酸从丝氨酸变为脯氨酸,这一发现开启了Pol θ的研究起源[2]。此后,Wood实验室纯化了全长人源 Polθ,并证实它具有DNA合成和DNA依赖性ATP酶活性[3]。Polθ是人类基因组中15种 DNA聚合酶之一,包含一个C-末端A家族DNA聚合酶和N末端超家族2(SF2)型DNA解旋酶,中间由长且保守程度较低的未知功能中心域隔开。
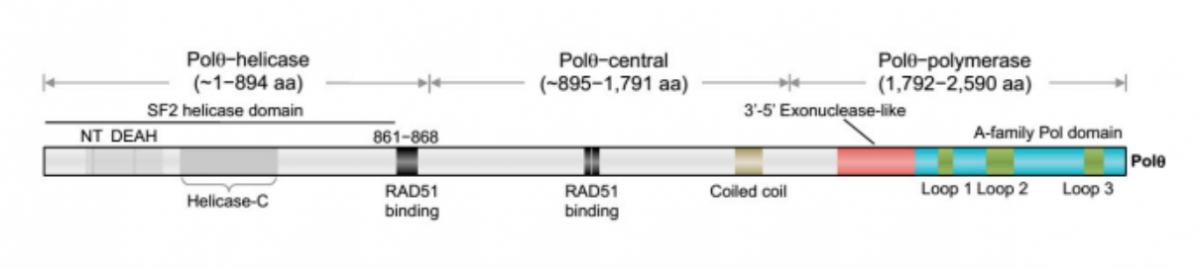
Polθ示意图[4]。超家族2 (SF2) 解旋酶结构域包含一个保守的核苷酸结合位点(NT,深灰色)、一个保守的 DEAH 盒基序(DEAH,深灰色)和一个保守的解旋酶C端结构域(Helicase-C,深灰色)。RAD51 结合域(黑色)位于解旋酶和中央域中。聚合酶结构域包含一个保守的A家族聚合酶亚结构域(蓝色)、一个无活性的 3'-5' 核酸外切酶样亚结构域(红色)和三个独特的插入环(绿色)。
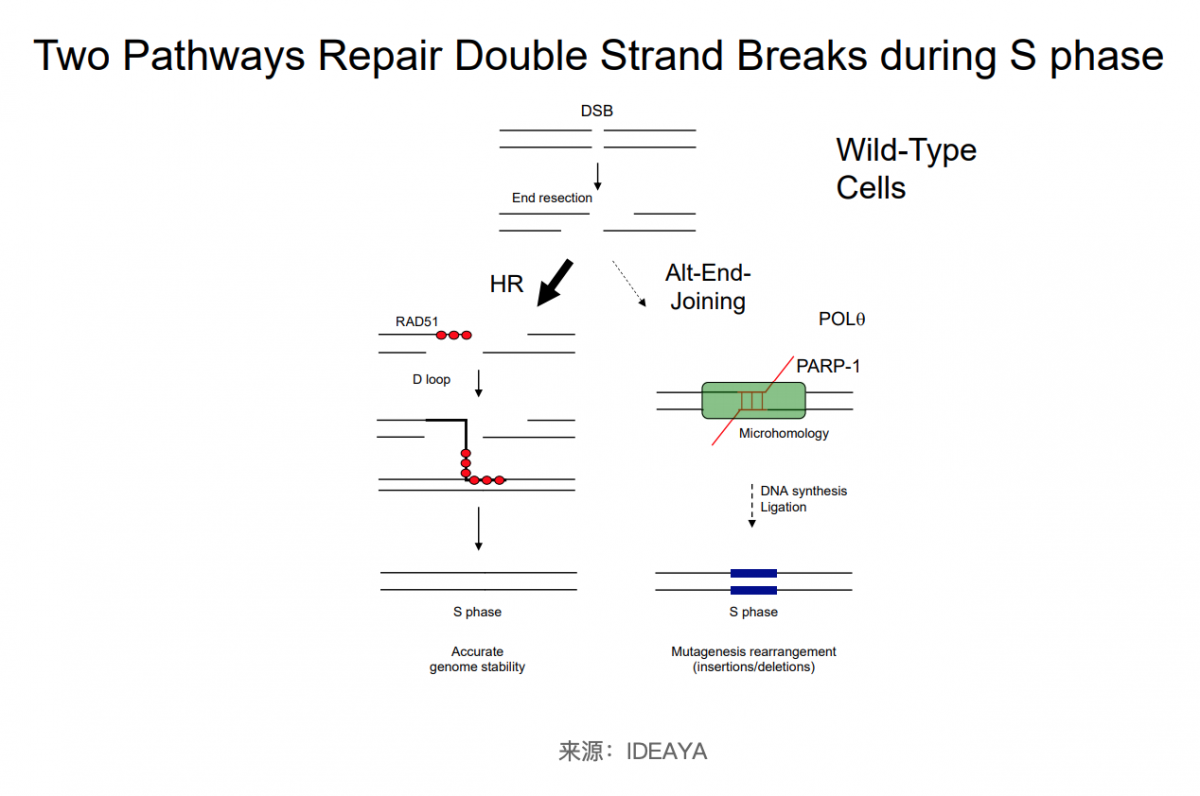
哺乳动物细胞已经进化出多种途径来修复DNA双链断裂 (DSB) 以确保基因组稳定性。DNA 聚合酶 theta (Polθ) 是替代末端连接(alt-EJ)通路的关键组成部分,也称为微同源介导的末端连接 (MMEJ) 通路,参与DNA双链断裂修复。MMEJ是除了非同源末端连接 (NHEJ) 和同源重组 (HR)之外,细胞的另外一种修复途径。MMEJ的修复是由DNA末端侧翼的微同源序列的退火驱动,最初被认为是基因修复的备用途径,随着研究进展,也发现MMEJ并非是一种备份的修复机制 [5]。
当发生DNA末端切除时,在存在BRCA2的情况下,BRCA2不仅将重组酶RAD51募集到DSB 以促进HR,而且还抑制alt-NHEJ等修复途径。
当发生DNA末端切除时,在存在BRCA2的情况下,BRCA2不仅将重组酶RAD51募集到DSB 以促进HR,而且还抑制alt-NHEJ等修复途径。
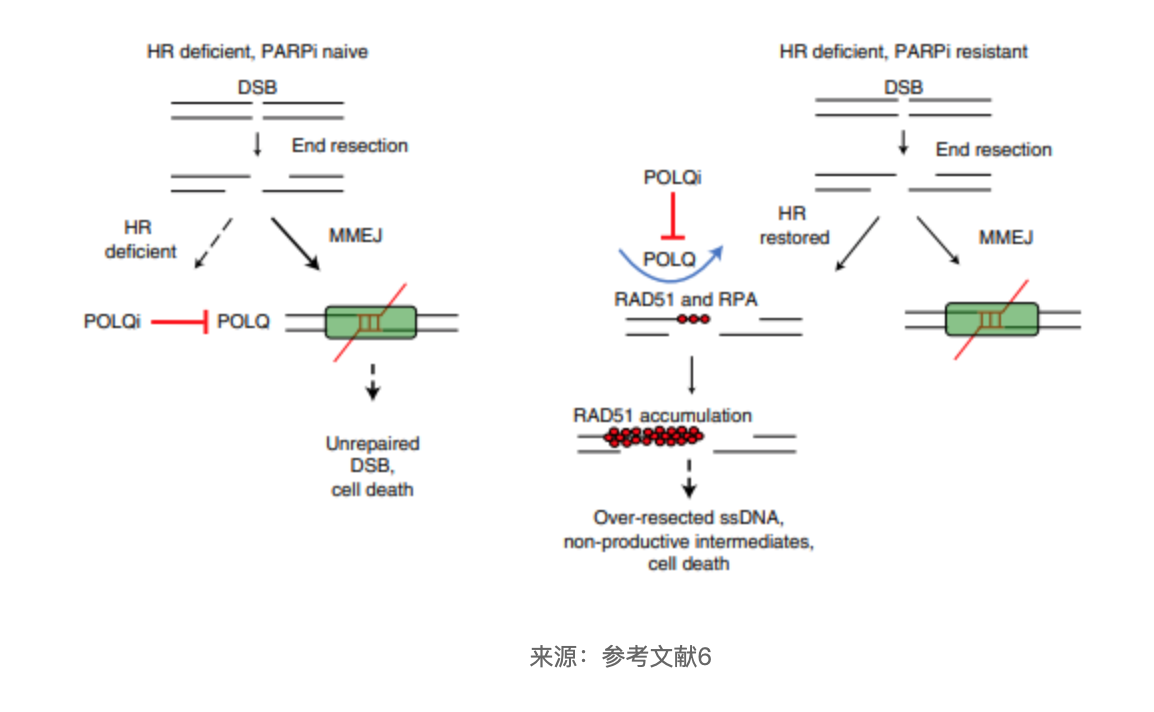
当同源重组介导的修复受到损害时(HR缺陷),如BRCA1或BRCA2突变,Polθ 高度表达并引导 DSB 修复朝向alt-EJ,开启微同源介导的末端连接(MMEJ)的DNA修复过程。在HR 缺陷的情况下,Polθ 的抑制通过毒性RAD51中间体的积累和alt-EJ修复途径的抑制,导致细胞死亡[6]。
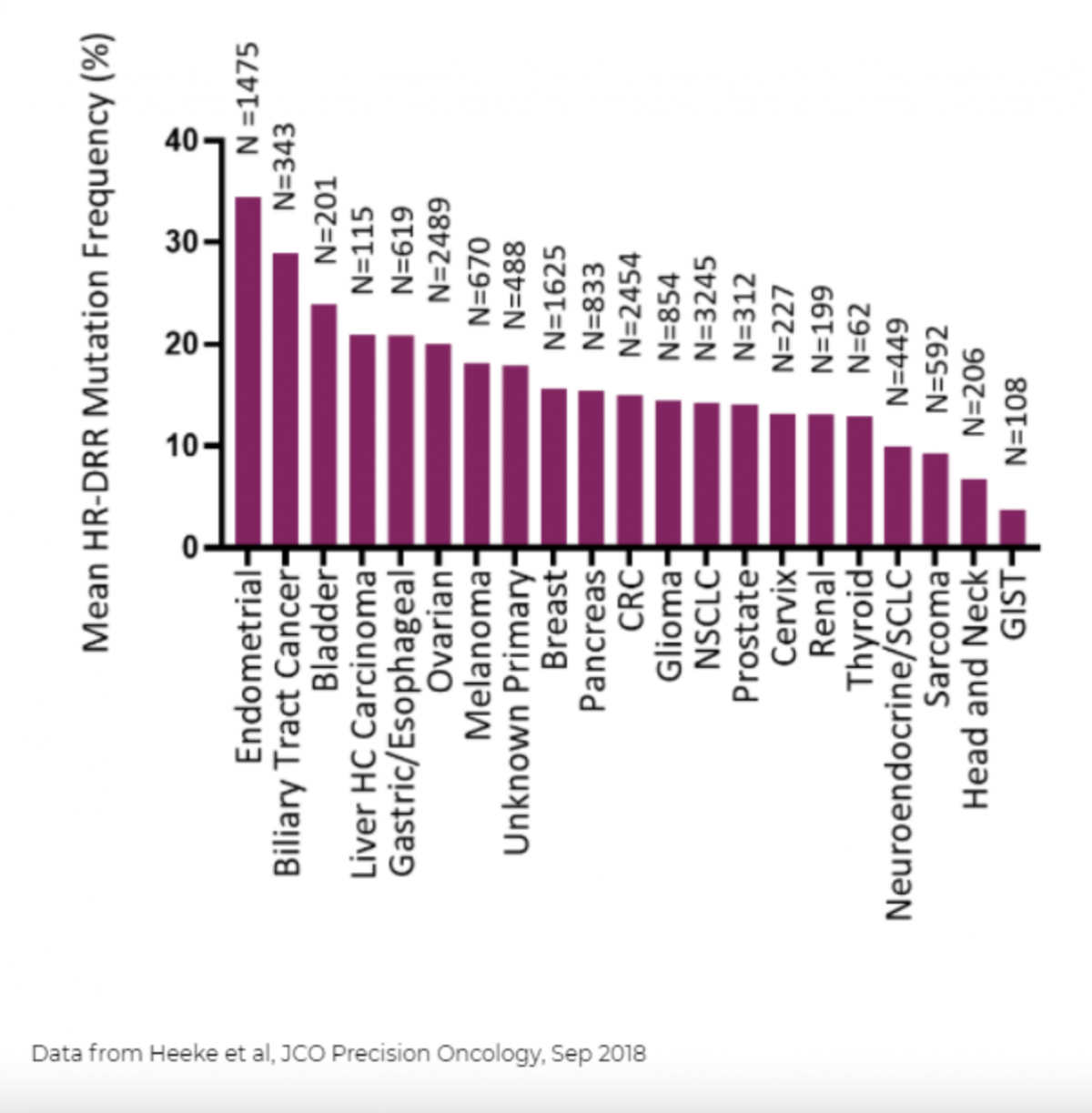
此外,Polθ还具有逆转录RNA并促进以RNA为模板的DNA修复功能[7]。Polθ 在正常组织中的几乎不表达,但在多种肿瘤类型(如乳腺癌、卵巢癌、HNSCC和肺癌)中高表达。同时,在这些瘤种中,又普遍存在同源重组修复缺陷(HRD);因此,Polθ抑制剂在这些瘤种中存在着应用的理论基础。
ART4215:潜力迸发,临床开启
根据医药魔方NextPharma数据,Artios开发的ART4215是首个也是唯一的临床Polθ抑制剂,Ideaya、Repare等也有相关项目正在开展。特别是Ideaya,与GSK正在展开多种策略的Polθ项目开发,并且已经公布部分Polθ抑制剂数据;根据本月刚更新的项目信息,Ideaya已经将战略转向Polθ降解剂。当然,除了Polθ抑制剂,Ideaya也在开展多个其他靶标的合成致死项目研究。
诺华也是GSK之外,另一个关注DDR的制药巨头。2021年4月,诺华与Artios达成最高达13亿美元的合作协议,以发现和验证下一代DDR项目,增强诺华放射配体疗法(造成DNA损伤),如177Lu-PSMA-617的临床潜力。此前,默克也与Artios达成了高达8.6亿美元的DDR领域合作协议。
尽管,ART4215目前公开的信息较少;不过,Artios在今年6月份的Nature Communications 上发表了选择性小分子 Polθ 聚合酶抑制剂的临床前数据和研究情况[8]。鉴于Artios开发的ART4215是唯一进入临床开发的Polθ抑制剂,并且,Artios的专利布局也包含ART588类骨架。因此,选择这篇文章作简单介绍。
与Ideaya不同, Artios在这篇文章中披露了一类高活性、高选择性的小分子Polθ聚合酶变构抑制剂。并且,揭示了ART558 在 BRCA1 或 BRCA2 突变肿瘤细胞中引起 DNA 损伤和合成致死,并增强 PARP抑制剂的作用。
尽管,ART4215目前公开的信息较少;不过,Artios在今年6月份的Nature Communications 上发表了选择性小分子 Polθ 聚合酶抑制剂的临床前数据和研究情况[8]。鉴于Artios开发的ART4215是唯一进入临床开发的Polθ抑制剂,并且,Artios的专利布局也包含ART588类骨架。因此,选择这篇文章作简单介绍。
与Ideaya不同, Artios在这篇文章中披露了一类高活性、高选择性的小分子Polθ聚合酶变构抑制剂。并且,揭示了ART558 在 BRCA1 或 BRCA2 突变肿瘤细胞中引起 DNA 损伤和合成致死,并增强 PARP抑制剂的作用。
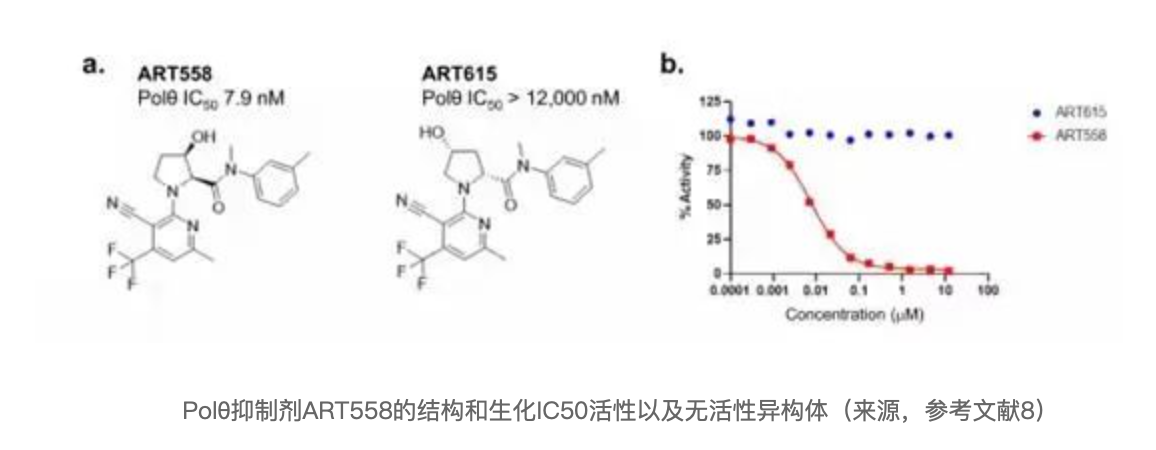
体外试验中,ART558对dNTP以及DNA显示非竞争性抑制,表明ART558结合于Polθ 的聚合酶催化结构域内的变构位点,并以剂量依赖性方式抑制MMEJ,细胞EC50为150 nM。同时,ART558也显示了高度选择性,不抑制其他人类DNA聚合酶,包括Polα、Polγ、Polη 和 Polν等。此外,只有ART558在 Polθ野生型而非Polθ null 小鼠胚胎干细胞中引起对放射的敏感性,ART615未显示相同作用;同样,也只有ART558显示了对BRCA 基因突变细胞的敏感性,并验证了POLQ 的遗传失活赋予 BRCA2 基因缺陷的合成致死率以及耐药PARP 抑制剂的复敏。
不过,ART558在大鼠微粒体中表现出较差的体外代谢稳定性;因此,采用了相似骨架且在大鼠体内实验中表现出良好的生物利用度和低清除率的Polθ 抑制剂 ART812,开展肿瘤异种移植模型中的抗癌疗效研究。
不过,ART558在大鼠微粒体中表现出较差的体外代谢稳定性;因此,采用了相似骨架且在大鼠体内实验中表现出良好的生物利用度和低清除率的Polθ 抑制剂 ART812,开展肿瘤异种移植模型中的抗癌疗效研究。
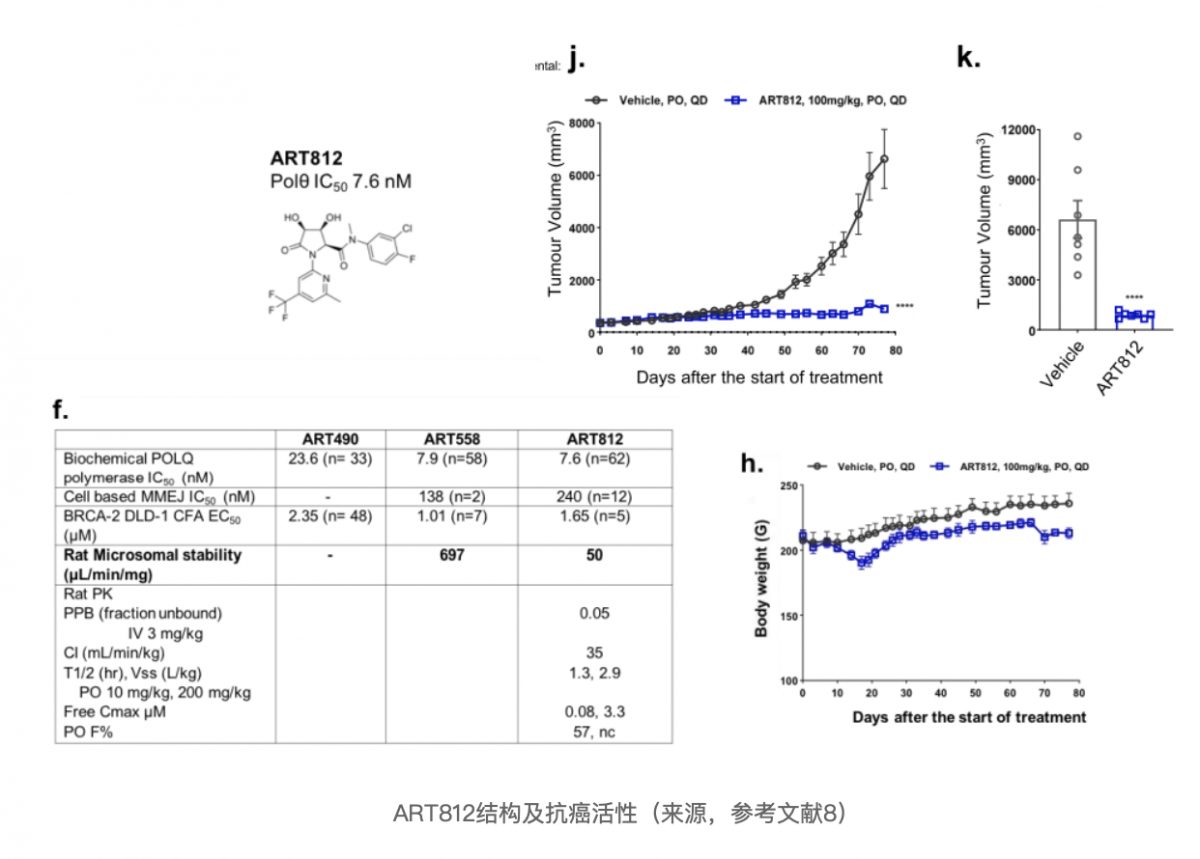
可以看出,ART812在体内显示了强大的单药功效,能够显著抑制肿瘤生长,并且动物体重变化较小,可以说具有了潜在的疗效和安全性。相信,如果ART4215也为相同的骨架化合物,一定会显示更优异的临床前数据。
总结
随着对Polθ研究深入,其潜在DDR功能也逐渐被关注。特别是Polθ蛋白结构的解析,得以借助AI或CADD等手段加速Polθ抑制剂的研究,对开展小分子抑制剂研究提供了强大的技术支撑。
虽然,ART4215刚刚公示临床信息,潜在临床治疗效果尚不明确。不过,基于多个体外和体内研究,特别是巨头的持续关注,可以看出Polθ也是具有强大的临床潜力,尤其在合成致死和PARP耐药瘤种中的应用。加之,鉴于目前布局和临床在研药物较少,Artios披露的临床前研究和数据也提供了重要参考,国内企业也不妨考虑提前介入。
此外,考虑RAD51在DDR中的功能以及唯一的临床药物CYT-0851在今年ASCO会议上披露的早期临床数据,也显示一定的单药治疗潜力。RAD51抑制剂和Polθ抑制剂或许也存在联合用药的可能,特别是在非BRCA1/BRCA2突变肿瘤中,有望进一步拓展两类药物的治疗领域。
参考资料
[1]Bridges, C.B., he origin of variations in sexual andsex-limited characters. Am.Nat., 1922. 56: p. 51-63
[2]Shima N, et al. Phenotype-based identification of mouse chromosome instability mutants. Genetics 2003, 163, 1031–1040
[3]Seki M, et al. POLQ (Pol theta), a DNA polymerase and DNA-dependent ATPase in human cells. Nucleic Acids Res. 2003, 31, 6117–6126
[4]Samuel J Black, et al. DNA Polymerase θ: A Unique Multifunctional End-Joining Machine. Genes 2016, 7, 67
[5]Alessandra Brambati,et al. DNA polymerase theta (Polu) – an error-prone polymerase necessary for genome stability. Current Opinion in Genetics & Development 2020, 60:119–126
[6]Jia Zhou, et al. A first-in-class polymerase theta inhibitor selectively targets homologous-recombinationdeficient tumors. Nature Cancer,2021:598–610
[7]Gurushankar Chandramouly, et al. Pol θ reverse transcribes RNA and promotes
总结
随着对Polθ研究深入,其潜在DDR功能也逐渐被关注。特别是Polθ蛋白结构的解析,得以借助AI或CADD等手段加速Polθ抑制剂的研究,对开展小分子抑制剂研究提供了强大的技术支撑。
虽然,ART4215刚刚公示临床信息,潜在临床治疗效果尚不明确。不过,基于多个体外和体内研究,特别是巨头的持续关注,可以看出Polθ也是具有强大的临床潜力,尤其在合成致死和PARP耐药瘤种中的应用。加之,鉴于目前布局和临床在研药物较少,Artios披露的临床前研究和数据也提供了重要参考,国内企业也不妨考虑提前介入。
此外,考虑RAD51在DDR中的功能以及唯一的临床药物CYT-0851在今年ASCO会议上披露的早期临床数据,也显示一定的单药治疗潜力。RAD51抑制剂和Polθ抑制剂或许也存在联合用药的可能,特别是在非BRCA1/BRCA2突变肿瘤中,有望进一步拓展两类药物的治疗领域。
参考资料
[1]Bridges, C.B., he origin of variations in sexual andsex-limited characters. Am.Nat., 1922. 56: p. 51-63
[2]Shima N, et al. Phenotype-based identification of mouse chromosome instability mutants. Genetics 2003, 163, 1031–1040
[3]Seki M, et al. POLQ (Pol theta), a DNA polymerase and DNA-dependent ATPase in human cells. Nucleic Acids Res. 2003, 31, 6117–6126
[4]Samuel J Black, et al. DNA Polymerase θ: A Unique Multifunctional End-Joining Machine. Genes 2016, 7, 67
[5]Alessandra Brambati,et al. DNA polymerase theta (Polu) – an error-prone polymerase necessary for genome stability. Current Opinion in Genetics & Development 2020, 60:119–126
[6]Jia Zhou, et al. A first-in-class polymerase theta inhibitor selectively targets homologous-recombinationdeficient tumors. Nature Cancer,2021:598–610
[7]Gurushankar Chandramouly, et al. Pol θ reverse transcribes RNA and promotes
RNA-templated DNA repair. Chandramouly et al., Sci. Adv. 2021; 7 : eabf1771
[8]Diana Zatreanu, et al. Polθ inhibitors elicit BRCA-gene synthetic lethality
and target PARP inhibitor resistance. NATURE COMMUNICATIONS | (2021) 12:3636


