今日,第一三共(Daiichi Sankyo)宣布,美国FDA已授予patritumab deruxtecan(HER3-DXd)突破性疗法认定(BTD)。这是一款潜在“first-in-class”的HER3靶向在研抗体偶联药物(ADC),用于治疗接受第三代酪氨酸激酶抑制剂(TKI)和含铂疗法治疗期间或治疗后,发生疾病进展且携带耐药性EGFR突变的转移性或局部晚期非小细胞肺癌(NSCLC)患者。
肺癌是全球第二大常见癌症和癌症相关死亡的主要原因,其中80%-85%为NSCLC。大约15%-50%的NSCLC患者携带EGFR突变。虽然表皮生长因子受体(EGFR)TKI靶向治疗在携带EGFR突变晚期NSCLC(约占30%的患者)的疗效已得到充分验证,但治疗产生的耐药性通常会导致疾病进展。EGFR TKI失败后,含铂化疗的疗效有限,患者的无进展生存期(PFS)仅约为4.4-6.4个月。携带EGFR突变的NSCLC患者肿瘤细胞约83%表达HER3蛋白。HER3是受体酪氨酸激酶EGFR家族的成员之一,与异常细胞增殖和存活相关,可能与转移发生率增加、生存率降低和对标准治疗的耐药性有关。
Patritumab deruxtecan采用第一三共公司专有的DXd ADC技术设计,由人源化抗HER3抗体与拓扑异构酶I抑制剂(topoisomerase I inhibitor)有效载荷,通过一个四肽连接子连接而成。
肺癌是全球第二大常见癌症和癌症相关死亡的主要原因,其中80%-85%为NSCLC。大约15%-50%的NSCLC患者携带EGFR突变。虽然表皮生长因子受体(EGFR)TKI靶向治疗在携带EGFR突变晚期NSCLC(约占30%的患者)的疗效已得到充分验证,但治疗产生的耐药性通常会导致疾病进展。EGFR TKI失败后,含铂化疗的疗效有限,患者的无进展生存期(PFS)仅约为4.4-6.4个月。携带EGFR突变的NSCLC患者肿瘤细胞约83%表达HER3蛋白。HER3是受体酪氨酸激酶EGFR家族的成员之一,与异常细胞增殖和存活相关,可能与转移发生率增加、生存率降低和对标准治疗的耐药性有关。
Patritumab deruxtecan采用第一三共公司专有的DXd ADC技术设计,由人源化抗HER3抗体与拓扑异构酶I抑制剂(topoisomerase I inhibitor)有效载荷,通过一个四肽连接子连接而成。
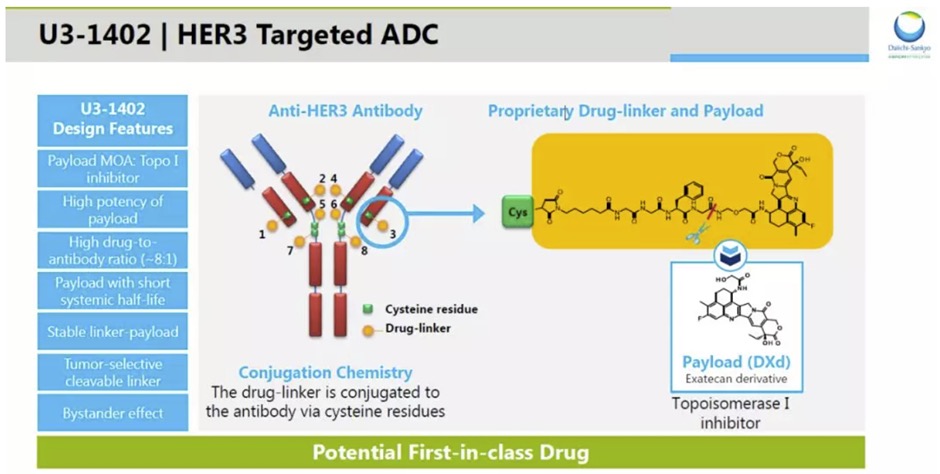
▲Patritumab deruxtecan(U3-1402)简介
(图片来源:第一三共官网)
(图片来源:第一三共官网)
本次突破性疗法认定是基于该药一项三队列1期临床试验目前获得的积极数据。在2021年美国临床肿瘤学会(ASCO)上发布的结果显示,57名接受patritumab deruxtecan(5.6 mg/kg)治疗的入组患者客观缓解率(ORR)达到39%(CI 95%:26-52%),疾病控制率为72%(CI 95%:59-83%),中位无进展生存期(PFS)为8.2个月。安全性方面,在接受5.6 mg/kg剂量治疗的患者(n=57)中的安全性特征与先前研究一致。
参考资料:
[1] Patritumab Deruxtecan Granted U.S. FDA Breakthrough Therapy Designation in Patients with Metastatic EGFR-Mutated Non-Small Cell Lung Cancer. Retrieved December 23, 2021, from https://www.daiichisankyo.com/files/news/pressrelease/pdf/202112/20211223_E1.pdf
(原文有删减)


