12月20日,诺华宣布了ligelizumab治疗慢性自发性荨麻疹(CSU)两项III期PEARL 1和PEARL 2研究的关键结果,显示ligelizumab在第12周相比安慰剂显示优效,但相比奥马珠单抗未显示优效,未能达到主要终点。这两项研究的详细结果将在2022年下半年试验完成后公布。
Ligelizumab是诺华开发的下一代抗IgE单抗,可以高亲和力结合IgE,通过阻断IgE/FcεRI通路发挥作用,IgE/FcεRI通路是过敏性疾病炎症过程的关键驱动因子。与奥马珠单抗相比,Ligelizumab具有更高的选择性和不同的结合位点,有望成为新的治疗标准。
Ligelizumab是诺华开发的下一代抗IgE单抗,可以高亲和力结合IgE,通过阻断IgE/FcεRI通路发挥作用,IgE/FcεRI通路是过敏性疾病炎症过程的关键驱动因子。与奥马珠单抗相比,Ligelizumab具有更高的选择性和不同的结合位点,有望成为新的治疗标准。
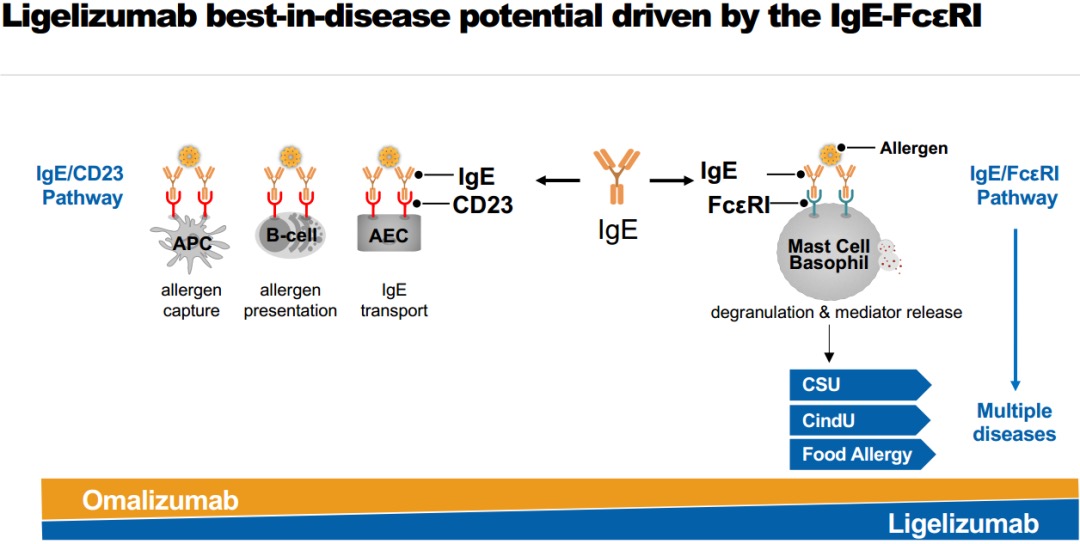
Ligelizumab曾在今年1月获得FDA突破性疗法认定,是第一个在H1抗组胺治疗应答不充分型慢性自发性荨麻疹上获得FDA突破性疗法资格的药物。在针对中重度慢性自发性荨麻疹患者开展的IIb期剂量探索性研究中,与奥马珠单抗相比,ligelizumab组荨麻疹得到完全缓解人数更多(51% vs. 26%)。
慢性自发性荨麻疹是一种不可预测的全身性皮肤病,其特征是皮肤上自发和反复出现瘙痒和风疹、血管性水肿,或两者兼而有之,持续至少6周,影响多达1%的人群。大约60%的患者在接受抗组胺药一线治疗后无法完全控制病情。当前,慢性自发性荨麻疹治疗药物稀缺,仅有3款药物获批。自2003年奥玛珠单抗获批之后更是长达近20年再无新药获批。除了ligelizumab之外,诺华还在今年中将BTK抑制剂remibrutinib治疗慢性自发性荨麻疹推向III期临床。
诺华全球研发负责人兼首席医学官John Tsai表示:“我们对ligelizumab在CSU患者中未能证明优于标准疗法感到遗憾。但是我们会继续评估ligelizumab在治疗慢性诱导性荨麻疹(CIndU)和食物过敏方面的潜力。这两种疾病同样存在巨大的未满足需求。 ”


