
普那布林“身份证”
姓名:普那布林,plinabulin,BPI-2358,NPI-2358,KPU-2
类型:鸟嘌呤核苷酸交换因子 H1(guanine nucleotide exchange factor H1,GEF-H1)激活剂
作用机制:激活GEF-H1,加速树突状细胞(DC细胞)的成熟,促进抗原呈递和T细胞活化。此外,普那布林还可促进造血干细胞和祖细胞(HSPC)的成熟,具有中性粒细胞保护作用。
公司:BeyondSpring Pharmaceuticals(万春医药,美国),Nippon Steel & Sumitomo Metal,Nereus Pharmaceuticals,恒瑞医药
审评审批类型:突破性疗法(US),突破性疗法(CN),重大专项(CN),优先审评(CN),特殊审批(CN)
研发进度
化疗引起的中性粒细胞减少症——申请上市
非小细胞肺癌——III期临床
小细胞肺癌——I期临床
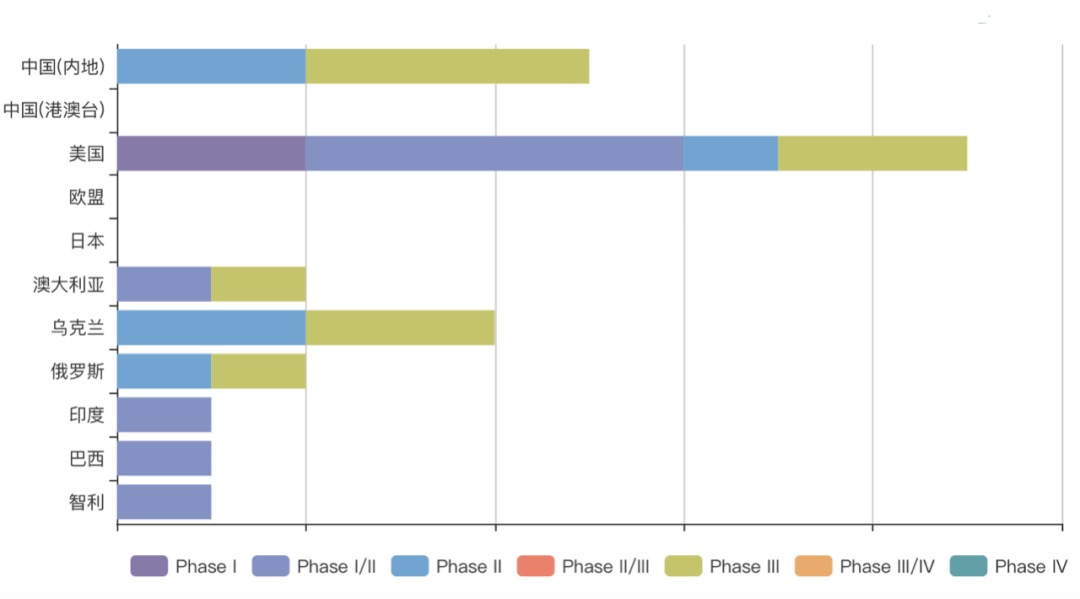
临床试验统计(按国家)
全球临床试验分期占比
图片来自:医药魔方NextPharma数据库

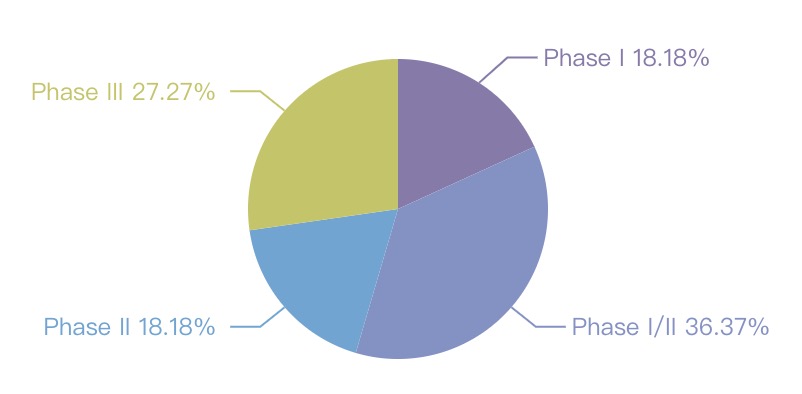
全球临床试验分期占比

图片来自:医药魔方NextPharma数据库
化疗引起的中性粒细胞减少症(CIN)
CIN是化疗常见的不良反应,其可能导致化疗药物剂量降低、化疗时间延迟、粒细胞减少性发热(FN)和感染,从而增加治疗费用、降低化疗效果和生存质量,并可影响患者预后。正确评估CIN的发生风险,进行合理的预防和治疗,对提高肿瘤治疗的整体疗效、降低死亡风险等方面具有重要的意义。———《肿瘤化疗导致的中性粒细胞减少诊治专家共识(2019版)》
试验编号:NCT03294577 [1][2]
试验简称:BPI-2358-106,PROTECTIVE-2
最新数据更新:2021.1.15
试验类型
一项全球、多中心、随机、双盲、III期临床研究,在接受TAC(多西他赛、阿霉素、环磷酰胺)治疗的乳腺癌患者中,评估“普那布林 + 培非格司亭” vs “培非格司亭”的疗效与安全性。
研究方法
研究分为两组,共纳入221例患者。组1(110例):TAC + 培非格司亭(6.0 mg)+ 安慰剂;组2(111例):TAC + 培非格司亭(6.0 mg)+ 普那布林(40 mg)。
研究终点
主要终点:未出现持续的严重中性粒细胞减少(duration of severe neutropenia,DSN)的患者比例。
其他终点:平均DSN评估,平均绝对中性粒细胞计数(ANC)最低值,未发生3~4级中性粒细胞减少症患者的比例,15天内平均DSN评估,以及其他安全性评估。
有效性
主要终点:联合治疗组 31.5%,培非格司亭单药治疗组 13.6%,P=0.0015。
关键次要终点:第一个治疗周期的DSN、ANC最低值等指标,均显示出统计学意义。
安全性
与培非格司亭单药治疗组(80.0%)相比,联合治疗组的4级AE发生率(58.6%)更低。
图片来自:Pixabay
试验编号:NCT03102606 [3][4]
试验简称:BPI-2358-105,PROTECTIVE-1
最新数据更新:ASCO 2021(2021.6)
试验类型
多中心、随机、双盲、III期临床研究,评估单药普那布林和培非格司亭在预防CIN中的作用。
研究方法
根据NCCN标准,纳入具有至少1个危险因素的乳腺癌、非小细胞肺癌(NSCLC)、前列腺癌患者,共105名。接受多西他赛联合培非格司亭(n=53)或联合普那布林(n=52)至少4个周期。
研究终点
主要终点:与培非格司亭相比,单药普那布林在预防DSN方面的非劣效性。
其他终点:第一个治疗周期(C1)的血小板计数,C1骨痛评分,C1-4 CIN相关的后遗症[ 包括粒细胞减少性发热(FN)、感染、抗生素使用及住院率、停用多西他赛或延迟使用 ],其他安全性(AEs,生命体征)数据。
有效性
主要终点方面,普那布林达到了非劣效的标准。
其他终点:C1时,两组间的4级毒性没有显著差异(P=NS);CIN相关的后遗症方面,与培非格司亭相比,普那布林结果相当或稍好:普那布林组的骨痛、血小板减少症更少。
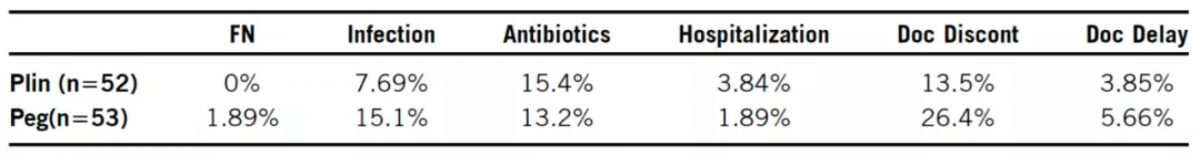
注:Plin 普那布林,Peg 培非格司亭
安全性
AE发生率和整体安全性,两组相当。
非小细胞肺癌(NSCLC)
免疫检查点抑制剂(CPI)已被广泛应用于NSCLC的一线治疗。在二/三线,仍是以多西他赛为基础的化疗为主要治疗方案。但是,化疗的安全性问题令人担忧,如严重的CIN。因此,目前NSCLC二线/三线治疗仍有很大的、未被满足的治疗需求。——Trevor M. Feinstein博士(DUBLIN-3的主要研究者之一)
试验编号:NCT02504489 [5]
试验简称:DUBLIN-3,BPI-2358-103
最新数据更新:ESMO 2021
试验类型
在一线含铂化疗后疾病进展,且EGFR野生型的二/三线NSCLC患者中进行的国际多中心III期、随机、对照临床研究。对比普那布林和多西他赛联合治疗组与多西他赛单药治疗组的疗效与安全性。
研究方法
两组受试者,均在每个化疗周期(21天)的第1天接受多西他赛治疗,联合治疗组在第1天多西他赛给药后1小时和第8天给予普那布林,全球共纳入559例患者。
研究终点
主要终点:总生存期(OS)
次要终点:客观缓解率(ORR)、无进展生存期(PFS)、4级中性粒细胞减少症发生率、24个月和36个月的总生存率、缓解持续时间(DOR)和生活质量等。
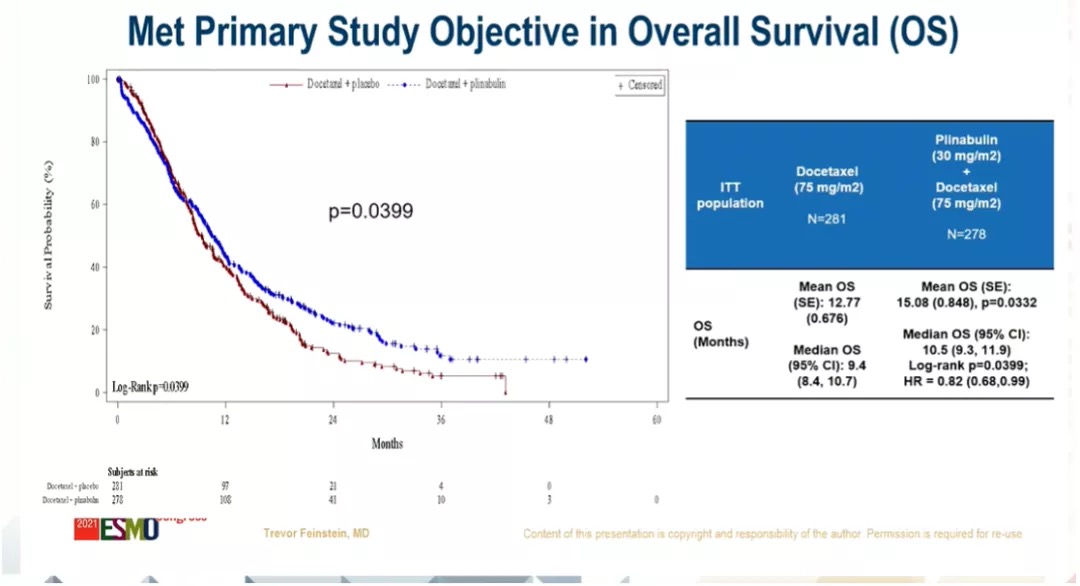
有效性
多西他赛+普那布林组 vs 多西他赛组,平均OS分别为:15.08 m,12.77 m(P=0.0332);中位OS分别为:10.5 m,9.4 m(Log-rank P=0.0399,HR=0.82);24个月OS率分别为:22.1%,12.5%;36个月OS率分别为:11.7%,5.3%;48个月OS率分别为:10.6% ,0%。
试验简称:DUBLIN-3,BPI-2358-103
最新数据更新:ESMO 2021
试验类型
在一线含铂化疗后疾病进展,且EGFR野生型的二/三线NSCLC患者中进行的国际多中心III期、随机、对照临床研究。对比普那布林和多西他赛联合治疗组与多西他赛单药治疗组的疗效与安全性。
研究方法
两组受试者,均在每个化疗周期(21天)的第1天接受多西他赛治疗,联合治疗组在第1天多西他赛给药后1小时和第8天给予普那布林,全球共纳入559例患者。
研究终点
主要终点:总生存期(OS)
次要终点:客观缓解率(ORR)、无进展生存期(PFS)、4级中性粒细胞减少症发生率、24个月和36个月的总生存率、缓解持续时间(DOR)和生活质量等。
有效性
多西他赛+普那布林组 vs 多西他赛组,平均OS分别为:15.08 m,12.77 m(P=0.0332);中位OS分别为:10.5 m,9.4 m(Log-rank P=0.0399,HR=0.82);24个月OS率分别为:22.1%,12.5%;36个月OS率分别为:11.7%,5.3%;48个月OS率分别为:10.6% ,0%。
亚组分析显示,生存获益与接受普那布林治疗的周期数直接相关,接受普那布林治疗≥4或≥8个周期者的生存期显著延长。
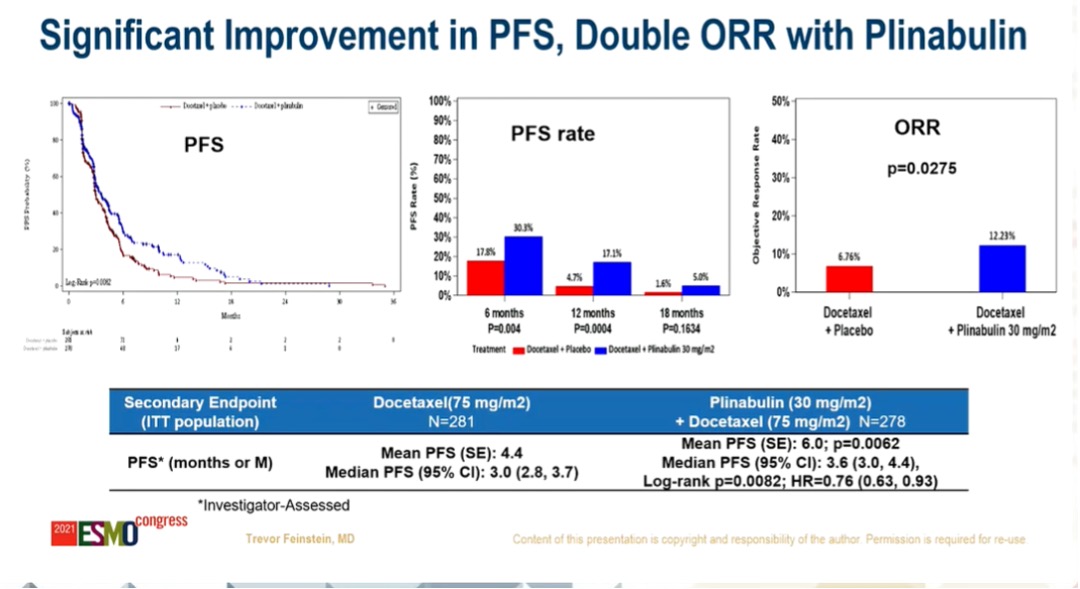
多西他赛+普那布林组 vs 多西他赛组,平均PFS分别为:6.0 m,4.4 m(P=0.0062),中位PFS分别为:3.6 m,3.0 m(Log-rank P=0.0082,HR=0.76);ORR分别为:12.23%,6.76%(P=0.0275)。
多西他赛+普那布林组 vs 多西他赛组,平均PFS分别为:6.0 m,4.4 m(P=0.0062),中位PFS分别为:3.6 m,3.0 m(Log-rank P=0.0082,HR=0.76);ORR分别为:12.23%,6.76%(P=0.0275)。
安全性
普那布林联合组的4级中性粒细胞减少症的发生率显著下降:C1第8天:27.8% vs 5.26%;全部疗程第8天:33.58% vs 5.13%。联合治疗组患者的生活质量更佳,普那布林能显著减少4级AE的事件数。
普那布林联合组的4级中性粒细胞减少症的发生率显著下降:C1第8天:27.8% vs 5.26%;全部疗程第8天:33.58% vs 5.13%。联合治疗组患者的生活质量更佳,普那布林能显著减少4级AE的事件数。
小细胞肺癌(SCLC)
SCLC仍存在巨大的、未被满足的治疗需求。该研究支持这样一种假设,在免疫检查点抑制剂(CPI)的基础上联合普那布林,能提高二线/三线SCLC的治疗反应率;部分先前对免疫治疗耐药者,也可表现出持久的应答和肿瘤缩小。此外,普那布林还可减少免疫治疗限制性AE。——Jyoti Malhotra博士(BTCRC-LUN17-127的主要研究者之一)
试验编号:NCT03575793 [6]
试验简称:BTCRC-LUN17-127
最新数据更新:ASCO 2021(2021.6)
试验类型
I期临床试验
研究方法
使用3+3设计,纳入既往接受铂类化疗(±免疫检查点抑制剂)期间或之后出现进展的晚期SCLC患者,给与纳武利尤单抗(1 mg/kg)+伊匹木单抗(3 mg/kg)+普那布林(按剂量递增计划)。完成4个治疗周期后,患者每2周继续接受纳武利尤单抗(240 mg)+普那布林,直至疾病进展或不能耐受的毒性。截止2020年11月,共纳入17例患者。
研究终点
主要终点:确定剂量限制性毒性(DLT),以及II期试验的推荐剂量(RP2D)
其他终点:ORR,PFS,AE发生情况
有效性
主要终点方面,30 mg/m2被定为RP2D。CPI初治患者中有3个PR(3/6,50%),可评估的CPI耐药患者中有2个PR(2/7,29%),有应答的两名CPI耐药患者中,肿瘤缩小分别为68%和52%。
安全性
最常见的AE包括:恶心(10,63%)、输液反应(8,50%)、呕吐(7,44%)、腹泻(7,44%)、疲劳(6,32%)。7名患者出现至少一个3级以上的治疗相关AE,未见治疗相关性死亡。
参考文献
1、www.clinicaltrials.gov
2、万春布林官方微信:重磅:打破CIN领域30年沉寂,普那布林国际多中心III期临床试验PROTECTIVE-2达到主要和所有关键次要终点
3、ASCO 2021,Poster Session 547
4、JAMA Oncol. 2020; 6(11): e204429.
5、ESMO 2021,Abstract # 3797
6、ASCO 2021,Poster Session 8570



 上一篇
上一篇 下一篇
下一篇




